
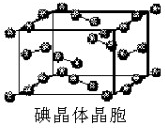
 如图为碘晶体晶胞结构.有关说法中正确的是
如图为碘晶体晶胞结构.有关说法中正确的是 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、用25mL量筒量取18.63mL盐酸 |
| B、用托盘天平称取12.15克食盐 |
| C、标准的NaOH溶液滴定未知浓度的盐酸,用去NaOH溶液32.30mL |
| D、用广泛pH试纸(1~14)测得某溶液pH为5.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用食醋可以除去暖水瓶中的薄层水垢 |
| B、用镊子取出白磷并置于水中切割 |
| C、硝酸溶液通常保存在棕色试剂瓶中,是因为硝酸见光易分解 |
| D、常温下浓硫酸可贮存在铁制或铝制容器中,说明常温下铁和铝与浓硫酸不反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
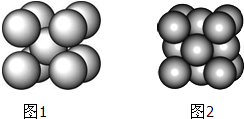 某金属(A)在TK以下晶体的基本结构单元如图1所示,T K以上转变为图2所示结构的基本结构单元,在两种晶体中最邻近的A原子间距离相同
某金属(A)在TK以下晶体的基本结构单元如图1所示,T K以上转变为图2所示结构的基本结构单元,在两种晶体中最邻近的A原子间距离相同| 金属 | 相对原子质量 | 分区 | 原子半径/pm | 密度/g?cm-3 | 原子化热/kJ?mol-1 |
| Na | 22.99 | s区 | 186 | 0.960 | 108.4 |
| A | 60.20 | d区 | r | 7.407 | 7735 |
| 3 |
| 200 |
| 27 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
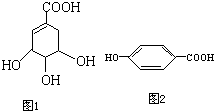 莽草酸是合成治疗禽流感的药物--达菲(Tamiflu)的原料之一.莽草酸是A的一种异构体.A的结构简式如图1所示:
莽草酸是合成治疗禽流感的药物--达菲(Tamiflu)的原料之一.莽草酸是A的一种异构体.A的结构简式如图1所示:查看答案和解析>>
科目:高中化学 来源: 题型:
| 操 作 | 现 象 |
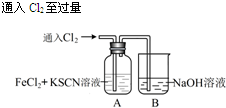 |
I.A中溶液变红 Ⅱ.稍后,溶液由红色变为黄色 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
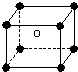 某离子化合物的晶胞如右图所示立体结构,晶胞是整个晶体中最基本的重复单位.阳离子位于此晶胞的中心,阴离子位于8个顶点,该离子化合物中,阴、阳离子个数比是( )
某离子化合物的晶胞如右图所示立体结构,晶胞是整个晶体中最基本的重复单位.阳离子位于此晶胞的中心,阴离子位于8个顶点,该离子化合物中,阴、阳离子个数比是( )| A、1:8 | B、1:4 |
| C、1:2 | D、1:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com