
【题目】今年是门捷列夫发现元素周期律150周年。下表是元素周期表的一部分,W、X、Y、Z为短周期主族元素,W与X的最高化合价之和为8。下列说法错误的是

A. 原子半径:W<X
B. 常温常压下,Y单质为固态
C. 气态氢化物热稳定性:Z<W
D. X的最高价氧化物的水化物是强碱
【答案】D
【解析】
W、X、Y和Z为短周期主族元素,依据位置关系可以看出,W的族序数比X多2,因主族元素族序数在数值上等于该元素的最高价(除F与O以外),可设X的族序数为a,则W的族序数为a+2,W与X的最高化合价之和为8,则有a+(a+2)=8,解得a=3,故X位于第IIIA族,为Al元素;Y为Si元素,Z为P元素;W为N元素,据此分析作答。
根据上述分析可知W、X、Y和Z为N、Al、Si和P,则
A. 同一周期从左到右元素原子半径依次减小,同一主族从上到下元素原子半径依次增大,则原子半径比较:N<Al,A项正确;
B. 常温常压下,Si为固体,B项正确;
C. 同一主族元素从上到下,元素非金属性依次减弱,气体氢化物的稳定性依次减弱,则气体氢化物的稳定性:PH3<NH3,C项正确;
D. X的最高价氧化物的水化物为氢氧化铝,即可以和强酸反应,又可以与强碱反应,属于两性氢氧化物,D项错误;
答案选D。


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:
【题目】有一处于平衡状态的反应:X(s)+3Y(g)![]() 2Z (g),ΔH<0。为了使平衡向生成Z的方向移动,应选择的条件是
2Z (g),ΔH<0。为了使平衡向生成Z的方向移动,应选择的条件是
①高温 ②低温 ③高压 ④低压 ⑤加催化剂 ⑥分离出Z
A. ①③⑤ B. ②③⑤ C. ②③⑥ D. ②④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关。下列说法错误的是
A. PM2.5是指粒径不大于2.5μm的可吸入悬浮颗粒物
B. 绿色化学要求从源头上消除或减少生产活动对环境的污染
C. 燃煤中加入CaO可以减少酸雨的形成及温室气体的排放
D. 天然气和液化石油气是我国目前推广使用的清洁燃料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水煤气变换[CO(g)+H2O(g)=CO2(g)+H2(g)]是重要的化工过程,主要用于合成氨、制氢以及合成气加工等工业领域中。回答下列问题:
(1)Shibata曾做过下列实验:①使纯H2缓慢地通过处于721 ℃下的过量氧化钴CoO(s),氧化钴部分被还原为金属钴(Co),平衡后气体中H2的物质的量分数为0.0250。
②在同一温度下用CO还原CoO(s),平衡后气体中CO的物质的量分数为0.0192。
根据上述实验结果判断,还原CoO(s)为Co(s)的倾向是CO_________H2(填“大于”或“小于”)。
(2)721 ℃时,在密闭容器中将等物质的量的CO(g)和H2O(g)混合,采用适当的催化剂进行反应,则平衡时体系中H2的物质的量分数为_________(填标号)。
A.<0.25 B.0.25 C.0.25~0.50 D.0.50 E.>0.50
(3)我国学者结合实验与计算机模拟结果,研究了在金催化剂表面上水煤气变换的反应历程,如图所示,其中吸附在金催化剂表面上的物种用![]() 标注。
标注。

可知水煤气变换的ΔH________0(填“大于”“等于”或“小于”),该历程中最大能垒(活化能)E正=_________eV,写出该步骤的化学方程式_______________________。
(4)Shoichi研究了467 ℃、489 ℃时水煤气变换中CO和H2分压随时间变化关系(如下图所示),催化剂为氧化铁,实验初始时体系中的PH2O和PCO相等、PCO2和PH2相等。

计算曲线a的反应在30~90 min内的平均速率![]() (a)=___________kPa·min1。467 ℃时PH2和PCO随时间变化关系的曲线分别是___________、___________。489 ℃时PH2和PCO随时间变化关系的曲线分别是___________、___________。
(a)=___________kPa·min1。467 ℃时PH2和PCO随时间变化关系的曲线分别是___________、___________。489 ℃时PH2和PCO随时间变化关系的曲线分别是___________、___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 配制FeCl3溶液时,将FeCl3固体溶解在硫酸溶液中,再加水稀释
B. 向含Fe3+的CuCl2溶液中加入CuO,调节pH可除去溶液中混有的Fe3+
C. 纯碱可用作锅炉除垢时CaSO4沉淀的转化剂
D. 将AlCl3·6H2O与SOCl2混合并加热,可得到无水AlCl3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E均为短周期的主族元素,其原子序数依次增大,A的原子电子层数等于其核外电子数,B与C可形成离子化合物CB2,D原子的M层电子数是K层电子数的3倍。
(1)A的元素符号是____。
(2)B的氢化物与E的氢化物相比,较稳定的是___(填化学式)。
(3)C、E组成的化合物的电子式是___,其中所含化学键的类型是___。
(4)B、D、E按原子半径由大到小的顺序排列为___(填元素符号)。
(5)C的最高价氧化物对应的水化物是___,它与D的最高价氧化物对应的水化物的稀溶液发生反应的离子方程式是____。
(6)欲证明E2的氧化性强于I2,可进行的实验操作是___,观察到的现象是___,有关反应的离子方程式是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T ℃,分别向10 mL浓度均为1 mol/L的两种弱酸HA、HB中不断加水稀释,并用pH传感器测定溶液pH。所得溶液pH的两倍(2pH)与溶液浓度对数(lgc)的关系如图所示。
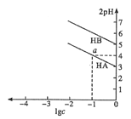
已知:pKa = -lgKa。
下列叙述正确的是
A. 弱酸的Ka随溶液浓度的降低而增大
B. a点对应的溶液中c(HA) = 0.1 mol/L,pH=4
C. 酸性:HA<HB
D. 弱酸HB的pKa≈5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作或装置能达到目的的是( )
A | B | C | D |
|
|
|
|
混合浓硫酸和乙醇 | 配制一定浓度的溶液 | 收集 | 证明乙炔可使溴水褪色 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH![]() 、—CH3、CH
、—CH3、CH![]() 都是重要的有机反应中间体,有关它们的说法正确的是( )
都是重要的有机反应中间体,有关它们的说法正确的是( )
A. 它们互为等电子体,碳原子均采取sp2杂化
B. CH![]() 与NH3、H3O+互为等电子体,立体构型均为正四面体形
与NH3、H3O+互为等电子体,立体构型均为正四面体形
C. CH![]() 中的碳原子采取sp2杂化,所有原子均共面
中的碳原子采取sp2杂化,所有原子均共面
D. CH![]() 与OH-形成的化合物中含有离子键
与OH-形成的化合物中含有离子键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com