
分析 (1)Cu2+有颜色;
(2)AgCl为不溶于稀硝酸的白色沉淀;
(3)加入过量NaOH溶液,出现白色沉淀,应为Mg(OH)2;
(4)NO3-与Ag+、Mg2+、Cu2+不生成沉淀,能共存.
解答 解:(1)由于溶液呈无色透明,而Cu2+有颜色,为蓝绿色,可以肯定原溶液中不存在Cu2+,故答案为:Cu2+;
(2)过量稀盐酸,有白色沉淀生成,再加入过量稀硝酸,白色沉淀不消失,说明原溶液中肯定有Ag+离子,反应的离子方程式为Ag++Cl-═AgCl↓,
故答案为:Ag+;Ag++Cl-═AgCl↓;
(3)在除去Ag+离子的溶液中,加入过量NaOH溶液,出现白色沉淀,则原溶液中一定存在Mg2+,
故答案为:Mg2+;
(4)由于Cl-和Ag+离子,CO32-、OH-与Mg2+、Cu2+都能生成沉淀,只有NO3-与Ag+、Mg2+、Cu2+不生成沉淀,故原溶液中可能大量存在的阴离子是NO3-,
故答案为:B.
点评 本题主要考查了离子的检验和离子共存问题,注意常见离子的性质和检验方法是解答的关键,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题

| A. | 用蒸馏水替代a中饱和食盐水产生的乙炔更为纯净 | |
| B. | c(过量)的作用是除去影响后续实验的杂质 | |
| C. | d、e褪色原理相同 | |
| D. | f处产生明亮的蓝色火焰 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 15% | B. | 10.05% | C. | 9.5% | D. | 5% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2S→SO2 | B. | Fe2+→Fe | C. | CO${\;}_{3}^{2-}$→CO2 | D. | 2H+→H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
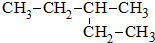
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在氧化还原反应中,非金属单质一定是氧化剂 | |
| B. | 含金属元素的离子不一定都是阳离子 | |
| C. | 某元素从化合态变为游离态时,该元素一定被还原 | |
| D. | 金属阳离子被还原时一定得到金属单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃时,pH均为2的H2SO4溶液和盐酸中氢离子的物质的量浓度 | |
| B. | 25℃时,pH均为2的盐酸和CH3COOH溶液中溶质的物质的量浓度 | |
| C. | 25℃时,同浓度的NaCl溶液和氨水的导电能力 | |
| D. | 25℃时,pH均为3的HCl和FeCl3溶液中水的电离程度 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com