
| 实验步骤(不要求写具体操作过程) | 预期现象和结论 |
| ① ② … | 若银镜消失,假设2成立. 若银镜不消失,假设2不成立. |


科目:高中化学 来源: 题型:
| A、HClO=ClO-+H+ |
| B、Cl-+H2O?HCl+OH- |
| C、CO32-+2H2O?H2CO3+2OH- |
| D、NH4++2H2O?NH3.H2O+H3O+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+ |
| B、加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- |
| C、加入硝酸银溶液有白色沉淀产生,一定有Cl- |
| D、加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | 甲醇 | 苯甲酸 | 苯甲酸甲酯 |
| 沸点/℃ | 64.7 | 249 | 199.6 |
| 相对分子质量 | 32 | 122 | 136 |
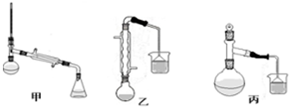
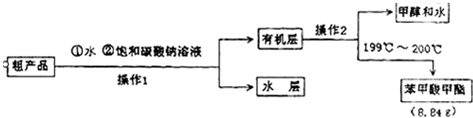
查看答案和解析>>
科目:高中化学 来源: 题型:
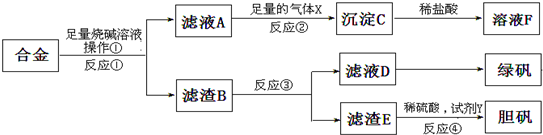
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铁、四氧化三铁、冰水混合物 |
| B、金属钙、生石灰、碱石灰 |
| C、水银、空气、干冰 |
| D、二氧化硫、水蒸气、天然气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
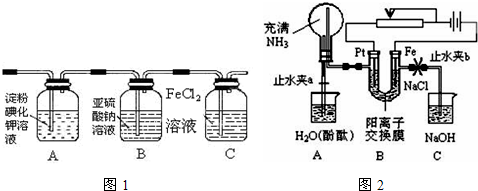
| 实验步骤 | 预期现象和结论 |
| 步骤1:取适量洗气瓶B中溶液于试管A中,滴加 | 若产生白色沉淀,则洗气瓶B溶液中存在SO42-. |
| 步骤2:另取适量洗气瓶B中溶液于试管B中,滴加 | 产生白色沉淀. |
| 步骤3:取步骤2后试管B中的上层清液于试管C中 滴加 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 序号 | 浓硝酸与水的体积比 | 实验现象 |
| Ⅰ | 1:1 | 反应速率快,溶液很快变成蓝色,铜丝表面有大量气泡冒出,气体呈红棕色 |
| Ⅱ | 1:3 | 反应速率较快,溶液变成蓝色,铜丝表面有大量气泡冒出,气体无色 |
| Ⅲ | 1:5 | 反应速率慢,微热后速率加快,溶液变成蓝色,铜丝表面有气泡冒出,气体无色 |
| 影响因素 | 实验步骤 | 实验结论 |
| 金属种类 | 两只烧瓶中各放入5g颗粒大小大致相同的Fe粉、Mg粉,分别加入 | 在该浓度的稀HNO3中,Mg能反应, |
| HNO3浓度 | 两只烧瓶中各放入5g颗粒大小大致相同的Mg粉,分别加入 | 硝酸浓度 |
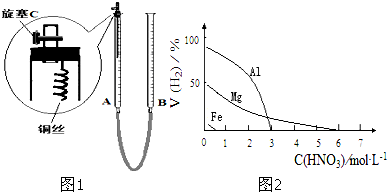
查看答案和解析>>
科目:高中化学 来源: 题型:
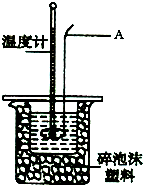 某实验小组用0.50mol?L-1NaOH溶液和0.50mol?L-1.1硫酸溶液进行中和热的测定.
某实验小组用0.50mol?L-1NaOH溶液和0.50mol?L-1.1硫酸溶液进行中和热的测定.| 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | 温度差(t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.6 | 26.6 | 26.6 | 29.1 | |
| 2 | 27.0 | 27.4 | 27.2 | 31.2 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com