
反应A(?)+aB(g) C(g)+2D(g)(a为正整数)。反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图所示,下列说法错误的是
C(g)+2D(g)(a为正整数)。反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图所示,下列说法错误的是
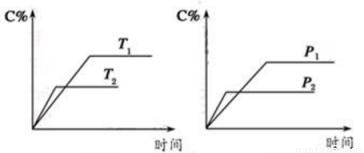
A.若a=2,则A为液态或固体
B.该反应的正反应为放热反应
C.T2>T1,p2>p1
D.其它条件不变,增加B的物质的量,平衡正向移动,平衡常数K增大
 通城学典默写能手系列答案
通城学典默写能手系列答案科目:高中化学 来源:2016-2017学年河北省高二上第二次月考化学试卷(解析版) 题型:选择题
加热N2O5,依次发生的分解反应为:①N2O5(g) N2O3(g)+O2(g), ②N2O3(g)
N2O3(g)+O2(g), ②N2O3(g) N2O(g)+O2(g).在容积为2L的密闭容器中充入8mol N2O5,加热到t℃,达到平衡状态后O2为9mol,N2O3为3.4mol.则t℃时反应①的平衡常数为( )
N2O(g)+O2(g).在容积为2L的密闭容器中充入8mol N2O5,加热到t℃,达到平衡状态后O2为9mol,N2O3为3.4mol.则t℃时反应①的平衡常数为( )
A.10.7 B.8.5 C.9.6 D.10.2
查看答案和解析>>
科目:高中化学 来源:2015-2016学年辽宁省高二下期初摸底化学卷(解析版) 题型:填空题
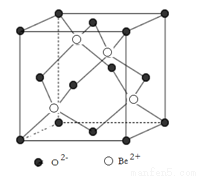
巴伊亚祖母绿号称是世界上最大的祖母绿矿石,重380余公斤,含有约18万克拉的祖母绿宝石,价值约4亿美元。祖母绿的元素组成是O、Si、Al、Be,化学式为Be3Al2Si6O18 。
(1)基态Al原子中,电子占据的最高能级的符号是 ,该能级具有的原子轨道数为 。
(2)在500~600℃气相中,氯化铍以二聚体Be2Cl4的形式存在(如图),在1000℃,氯化铍则以BeCl2形式存在。在BeCl2分子中,Be的杂化方式为 ,二聚体Be2Cl4中Be的杂化方式为 ,1mol Be2Cl4中含有 mol配位键。

(3)氢化铝锂(LiAlH4)是有机合成中的一种重要还原剂,可以将羧基还原为羟基,如可将乙酸还原为乙醇,乙酸和乙醇的熔沸点数据如下:
| 乙酸 | 乙醇 |
熔点/℃ | 16.6 | -114.3 |
沸点/℃ | 117.9 | 78.4 |
乙酸分子中σ键与π键数目之比为 ,由表格中的数据知,乙酸的熔沸点均比乙醇高,原因是 。
(4)图示为Be与O形成的氧化物的立方晶胞结构,已知氧化铍的密度ρ=3.00g/cm3,则晶胞参数a= nm。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年辽宁省高二下期初摸底化学卷(解析版) 题型:选择题
分类法是快速获取物质性质的重要方法,有关分类说法不正确的是
A.根据氧化物的性质可将氧化物分成酸性氧化物、碱性氧化物、两性氧化物和特殊氧化物等
B.根据反应中是否有电子转移将化学反应分为氧化还原反应和非氧化还原反应
C.根据分散质粒子直径大小可将液体分散系分为溶液、胶体和浊液
D.根据电解质的水溶液导电能力的强弱将电解质分为强电解质和弱电解质
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广东省高二上8月考试化学卷(解析版) 题型:选择题
反应X(g)+Y(g) 2Z(g) △H<0,达到平衡时,下列说法正确的是
2Z(g) △H<0,达到平衡时,下列说法正确的是
A.减小容器体积,平衡向右移动 B.加入催化剂,Z的产率增大
C.增大c(X),X的转化率增大 D.降低温度,Y的转化率增大
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广东省高二上8月考试化学卷(解析版) 题型:选择题
有一化学平衡:mA(g)+nB(g) pC(g)+qD(g)(如下图)表示的是转化率与压强、温度的关系。分析图中曲线可以得出的结论是
pC(g)+qD(g)(如下图)表示的是转化率与压强、温度的关系。分析图中曲线可以得出的结论是

A.正反应吸热:m+n>p+q B.正反应吸热:m+n<p+q
C.正反应放热:m+n>p+q D.正反应放热:m+n<p+q
查看答案和解析>>
科目:高中化学 来源:2015-2016学年内蒙古高一上第一次月考化学试卷(解析版) 题型:选择题
在1.01×105Pa,20℃时,下列气体各2.8L,其质量最大的是( )
A.N2 B.Cl2 C.NH3 D.SO2
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省高二上开学考试化学试卷(解析版) 题型:选择题
室温时,下列溶液等体积混合后pH一定小于7的是( )
A. pH=3的盐酸和pH=11的氨水 B. pH=3的盐酸和pH=11的氢氧化钡溶液
C. pH=3的硫酸和pH=11的氨水 D. pH=3的醋酸和pH=11的氢氧化钡溶液
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北沙市高二上第一次双周练化学卷(解析版) 题型:填空题
回答下列问题:
(1)已知下列反应:SO2 (g)+2OH–(aq) =SO32–(aq)+H2O(l) ΔH1;
ClO–(aq)+SO32–(aq)=SO42–(aq)+Cl–(aq) ΔH2;
CaSO4(s)=Ca2+(aq)+SO42–(aq) ΔH3。
则反应SO2(g)+Ca2+(aq)+ClO–(aq)+2OH–(aq)=CaSO4(s)+H2O(l)+Cl–(aq)的ΔH=______________。(用ΔH1、ΔH2、ΔH3表示)
(2)合成气(CO和H2为主的混合气体)不但是重要的燃料也是重要的化工原料,制备合成气的方法有多种,用甲烷制备合成气的反应为:①2CH4(g)+O2(g)=2CO(g)+4H2(g) ΔH1=-72 kJ·mol﹣1;
②CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH2=+216 kJ·mol﹣1。现 有1 mol由H2O(g)与O2组成的混合气,且O2的体积分数为x,将此混合气与足量CH4充分反应。
有1 mol由H2O(g)与O2组成的混合气,且O2的体积分数为x,将此混合气与足量CH4充分反应。
若x=0.2时,反应①放出的能量为________kJ;
若x=_________时,反应①与②放出(或吸收)的总能量为0。
(3)一定条件,在水溶液中1 mol Cl-和1 mol ClOx(x=1,2,3,4)的能量(kJ)相对大小如图所示。
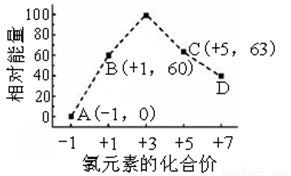
①D是________(填离子符号)。
②B→A+C反应的热化学方程式为_______________(用离子符号表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com