
【题目】根据下列实验操作和现象,所得结论正确的是( )
实验操作 | 现象 | 结论 | |
A | 向某溶液中先滴加硝酸酸化,再滴加BaCl2溶液 | 有白色沉淀生成 | 该溶液中含有SO |
B | 将蘸有浓氨水的玻璃棒靠近蘸有某溶液的玻璃棒 | 有白烟产生 | 该溶液是浓盐酸 |
C | 将某气体通入品红溶液中 | 溶液红色褪去 | 该气体可能是SO2 |
D | 向某溶液中滴加稀NaOH溶液时,将湿润的红色石蕊试纸置于试管口 | 试纸不变蓝 | 该溶液中不含NH |
A.A
B.B
C.C
D.D
科目:高中化学 来源: 题型:
【题目】高炉煤气为炼铁过程中产生的副产品,主要成分为N2、CO、CO2、H2O等,其中可燃成分CO含量约占25%左右,CO2、N2的含量分别占15%、55%。回答下列问题:
(1)上述提及的气体分子中,电子数相等的两种气体是_____________(写化学式)。
(2)CO可以用于生产甲醇,甲醇是一种重要的化工原料,有着重要的用途和应用前景。工业生产甲醇的常用方法是:CO(g)+2H2(g)=CH3OH(g) △H=-90.8kJ/mol
己知:2H2(g)+O2(g)═2H2O(l) △H=-571.6kJ·mol-1
2H2(g)+O2(g)═2H2O(g) △H=-483.6kJ`mol-1
①H2的燃烧热为___________________ kJ/mol。
②CH3OH(g)+O2(g)![]() CO(g) +2H2O(g)的反应热△H=___________________。
CO(g) +2H2O(g)的反应热△H=___________________。
③若在恒温恒容的容器内进行反应CO(g)+2H2(g)![]() CH3OH(g),则可用来判断该反应达到平衡状态的标志有______________________。(填字母)
CH3OH(g),则可用来判断该反应达到平衡状态的标志有______________________。(填字母)
A.CO百分含量保持不变 B.容器中H2浓度与CO浓度相等
C.容器中混合气体的密度保持不变 D.CO的生成速率与CH3OH的生成速率相等
(3)高炉煤气中N2的含量较高,利用CO前需要对CO 进行富集,实现CO和N2的分离。工业上常采用醋酸亚铜氨溶液来吸收CO,该反应的热化学方程式为 CH3COOCu(NH3)2(aq)+CO(g)![]() CH3COOCu(NH3)2·CO(aq) △H<0。吸收CO后的溶液经过适当处理可恢复为醋酸亚铜氨溶液,从而实现CO与吸收液的分离,分离过程可采取的措施有______________(写出一种即可)。
CH3COOCu(NH3)2·CO(aq) △H<0。吸收CO后的溶液经过适当处理可恢复为醋酸亚铜氨溶液,从而实现CO与吸收液的分离,分离过程可采取的措施有______________(写出一种即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下三组溶液:①植物油和水 ②氯化钠和单质碘的水溶液 ③40%的乙醇溶液,分离以上混合液的正确方法依次是
A. 分液、萃取、蒸馏 B. 萃取、蒸馏、分液
C. 分液、蒸馏、萃取 D. 蒸馏、萃取、分液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A2O82-离子在一定条件下可以把Mn2+离子氧化,若反应后A2O82-离子变为AO42-离子,又知反应中氧化剂和还原剂的物质的量之比为2︰1,Mn2+离子被氧化后Mn元素的化合价为
A. 4 B. 5 C. 6 D. 7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝分别与足量的稀盐酸和氢氧化钠溶液反应,当两个反应放出的气体在相同状况下体积相等时,反应中消耗的HCl和NaOH的物质的量之比为( )
A.1:1
B.2:1
C.3:1
D.1:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.金属钠保存于煤油中并置于阴凉处
B.蒸馏乙醚、乙醇等实验中,应远离明火
C.萃取振荡操作时,要及时打开分液漏斗上口玻璃塞放气
D.容量瓶洗净后可以晾干,也可烘干
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.石油分馏得到的各馏分仍是混合物
B.煤的气化、液化、干馏过程中都有化学变化
C.相同质量的乙炔、苯分别在足量氧气中燃烧,苯比乙炔消耗的氧气质量多
D.在一定条件下,苯与氢气生成环己烯的反应类型是加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近期发现,H2S是继NO、CO之后第三个生命体系气体信号分子,它具有参与调节神经信号传递、舒张血管减轻高血压的功能。回答下列问题:
(1)在密闭容器中充入一定量的H2S,发生反应2H2S(g)![]() 2H2(g)+S2 (g) 如图为H2S的转化率与温度、压强的关系。
2H2(g)+S2 (g) 如图为H2S的转化率与温度、压强的关系。
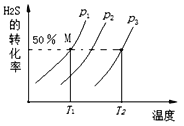
①该反应的ΔH__________0(填“>”、“=”或“<”);
②图中压强(p1、p2、p3)由小到大的顺序为_____________________;
③图中M点的平衡常数KP=_______________(KP是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(2)羰基硫(COS)是一种粮食熏蒸剂,能有效防止粮食被某些昆虫、线虫和真菌危害。在2 L的密闭容器中,保持温度T不变,将CO和H2S混合,并达下列平衡:CO(g)+H2S(g)![]() COS(g)+H2(g) K=0.2。开始投入9 molH2S和a mol CO,经10 min达到平衡。
COS(g)+H2(g) K=0.2。开始投入9 molH2S和a mol CO,经10 min达到平衡。
①若达平衡时n(H2S)=5mol,a 为_______。平衡时CO的转化率为________。
②曲线Ⅰ和Ⅱ表示该温度下,CO和H2S投料比[n(CO)/ n(H2S)]不同时,CO转化率随时间变化图像。则曲线Ⅰ和Ⅱ中a值的大小关系为:Ⅰ___Ⅱ(填“大于”“等于”“小于”),理由是____。
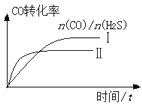
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电离平衡常数是衡量弱电解质电离程度的量,已知如表数据(25℃):
化学式 | 电离平衡常数 |
HCN | K=4.9×10-10 |
CH3COOH | K=1.8×10-5 |
H2CO3 | K1=4.4×10-7,K2=4.7×10-11、 |
(1)25℃时,下列物质的量浓度相同的四种溶液的pH由大到小的顺序为_____(填字母,下同)。
a.NaCN溶液 b.Na2CO3溶液 c.CH3COONa溶液 d.NaHCO3溶液
(2)25℃时,向NaCN溶液中通入少量CO2,所发生的化学方程式为____________________。
(3)醋酸钠溶液中各离子浓度由大到小的顺序为_________________________________。
(4)对于醋酸溶液和醋酸钠溶液的下列说法正确的是__________。
a.稀释醋酸溶液,醋酸的电离程度增大,而稀释醋酸钠溶液则醋酸钠的水解程度减小
b.升高温度可以促进醋酸电离,而升高温度会抑制醋酸钠水解
c.醋酸和醋酸钠的混合液中,醋酸促进醋酸钠的水解、醋酸钠也促进醋酸的电离
d.醋酸和醋酸钠的混合液中,醋酸抑制醋酸钠的水解、醋酸钠也抑制醋酸的电离
(5)物质的量浓度为0.1 mol/L 的 CH3COONa 溶液和 0.1 mol/LCH3COOH 溶液等体积混合(混合前后溶液体积变化忽略不计),混合液中的下列关系式正确的是__________。a.c(Na+)+c(H+)=c(CH3COO—)+c(OH-)
b.c(CH3COO—)+c(CH3COOH)=0.2 mol/L
c.c(CH3COOH)+2c(H+)=c(CH3COO—)+2c(OH—)
(6)若醋酸的起始浓度为1.0 mol/L,平衡时氢离子浓度c(H+)=_______。(已知: ![]() ≈1.4,计算结果保留两位有效数字)
≈1.4,计算结果保留两位有效数字)
(7)常温下,取20.00 mL氨水至锥形瓶中,用 0.05000 mol/L HCl滴定,用pH计采集数据,电脑绘制的滴定曲线如下图所示。当pH =11. 0 时,NH3H2O电离平衡常数Kb≈_______。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com