
分析 金属与醇反应,醇中-OH中的氢原子被还原生成氢气,根据H原子守恒可知,n(一元醇)=2n(H2),根据n=$\frac{V}{Vm}$计算氢气的物质的量,再根据M=$\frac{m}{n}$计算一元醇的摩尔质量,进而确定醇的分子式.
解答 解:标准状况下得到5.6L 氢气的物质的量为$\frac{5.6L}{22.4L/mol}$=0.25mol,所以n(一元醇)=2n(H2)=2×0.25mol=0.5mol,故该一元醇的摩尔质量为$\frac{30g}{0.5mol}$=60g/mol,去掉1个-OH剩余原子相对原子质量之和为60-17=43,可能为-CH2CH2CH3或-CH(CH3)2,分子式为3CH7O,可能结构简式为HOCH2CH2CH3或HOCH(CH3)2,
答:该有机物分子式分子式为3CH7O,可能结构简式为HOCH2CH2CH3或HOCH(CH3)2.
点评 本题考查有机物分子式的确定,比较基础,判断氢气与一元醇的物质的量关系是关键.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
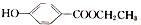 )是一种常用的食品添加剂,合成路线如下:
)是一种常用的食品添加剂,合成路线如下: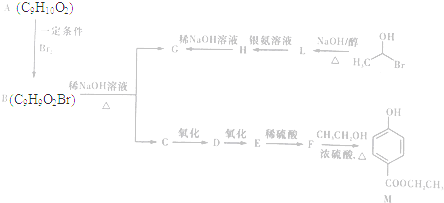
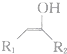 $\stackrel{不稳定、自动转化}{→}$
$\stackrel{不稳定、自动转化}{→}$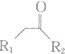 (R1、R2为H或烃基)
(R1、R2为H或烃基) 与稀氢氧化钠溶液不反应
与稀氢氧化钠溶液不反应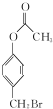 +3NaOH$\stackrel{△}{→}$
+3NaOH$\stackrel{△}{→}$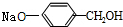 +CH3COONa+H2O+NaBr;
+CH3COONa+H2O+NaBr;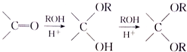 由乙烯、甲醇为有机原料制备化合物
由乙烯、甲醇为有机原料制备化合物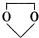 的合成路线流程图(无机试剂任选)如下:
的合成路线流程图(无机试剂任选)如下: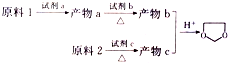
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2,3-二甲基-3,3-二乙基戊烷 | B. | 2-甲基-3-乙基丁烷 | ||
| C. | 2,3-二甲基-1-丁烯 | D. | 2,3-二甲基-1-丁炔 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
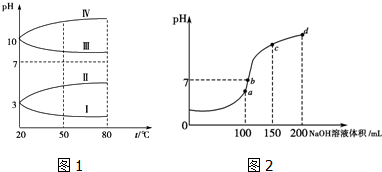
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
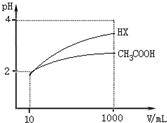 25℃时,三种酸的电离平衡常数如下:
25℃时,三种酸的电离平衡常数如下:| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | 1.8×10-5 | K1 4.3×10-7 K2 5.6×10-11 | 3.0×10-8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com