
(5分)二氧化硒(SeO2)是一种氧化剂,其被还原后的单质硒可能成为环境污染物,通过与浓HNO3或浓H2SO4反应生成SeO2以回收Se。完成下列填空:
(1)Se和浓HNO3反应的还原产物为NO和NO2,且NO和NO2的物质的量之比为1:1,写出Se和浓HNO3的反应方程式____ ____。
(2)已知:Se+2H2SO4(浓)→2SO2↑+SeO2+2H2O ; 2SO2+SeO2+2H2O→Se+2SO42-+4H+
则SeO2、H2SO4(浓)、SO2的氧化性由强到弱的顺序是____ __。
(3)回收得到的SeO2的含量,可以通过下面的方法测定,测定的原理如下:反应①发生后产生的I2,I2的量在反应②中被滴定,淀粉为指示剂,以Na2S2O3溶液为标准溶液
①SeO2+KI+HNO3→Se+I2+KNO3+H2O
②I2+2Na2S2O3→Na2S4O6+2NaI
实验中,准确称量SeO2样品0.2500g,消耗了0.2000 mol/L的Na2S2O3溶液25.00 mL,所测定的样品中SeO2的质量分数为_ __。
(5分)(1)Se+2HNO3(浓)=H2SeO3+NO↑+NO2↑ (2分);
(2)H2SO4(浓)>SeO2>SO2 (1分)
【解析】考查氧化还原反应的有关判断及计算等。
(1)根据还原产物NO和NO2的物质的量是1︰1可知,在反应中Se被浓硝酸氧化生成+4价的H2SeO3,所以反应的方程式是Se+2HNO3(浓)=H2SeO3+NO↑+NO2↑。
(2)在氧化还原反应中,氧化剂的氧化性强于氧化产物的,而还原剂的还原性强于还原产物的。所以根据反应的方程式可知,SeO2、H2SO4(浓)、SO2的氧化性由强到弱的顺序是H2SO4(浓)>SeO2>SO2。
(3)根据反应的方程式可知,SeO2~2I2~4Na2S2O3。所以样品中SeO2的物质的量是0.2000 mol/L×0.025L÷4=0.00125mol,则SeO2的质量是0.00125mol×111g/mol=0.13875g,所以样品中SeO2的质量分数为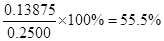 。
。


科目:高中化学 来源: 题型:
二氧化硒(SeO2)是一种氧化剂,其被还原后的单质硒可能成为环境污染物,通过与浓HNO3或浓H2SO4反应生成SeO2以回收Se。
完成下列填空:
27.Se和浓HNO3反应的还原产物为NO和NO2,且NO和NO2的物质的量之比为1:1,写出Se和浓HNO3的反应方程式________。
28.已知:Se+2H2SO4(浓)→2SO2↑+SeO2+2H2O
2SO2+SeO2+2H2O→Se+2SO42-+4H+
SeO2、H2SO4(浓)、SO2的氧化性由强到弱的顺序是______。
29.回收得到的SeO2的含量,可以通过下面的方法测定:
①SeO2+KI+HNO3→Se+I2+KNO3+H2O
②I2+2Na2S2O3→Na2S4O6+2NaI
配平方程式①,标出电子转移的方向和数目。
30.实验中,准确称量SeO2样品0.1500g,消耗了0.2000 mol/L的Na2S2O3溶液25.00 mL,所测定的样品中SeO2的质量分数为___。
查看答案和解析>>
科目:高中化学 来源:2013届福建省三明市泰宁一中高三第二次月考化学试卷(带解析) 题型:填空题
(5分)二氧化硒(SeO2)是一种氧化剂,其被还原后的单质硒可能成为环境污染物,通过与浓HNO3或浓H2SO4反应生成SeO2以回收Se。完成下列填空:
(1)Se和浓HNO3反应的还原产物为NO和NO2,且NO和NO2的物质的量之比为1:1,写出Se和浓HNO3的反应方程式____ ____。
(2)已知:Se+2H2SO4(浓)→2SO2↑+SeO2+2H2O ; 2SO2+SeO2+2H2O→Se+2SO42-+4H+
则SeO2、H2SO4(浓)、SO2的氧化性由强到弱的顺序是____ __。
(3)回收得到的SeO2的含量,可以通过下面的方法测定,测定的原理如下:反应①发生后产生的I2,I2的量在反应②中被滴定,淀粉为指示剂,以Na2S2O3溶液为标准溶液
①SeO2+KI+HNO3→Se+I2+KNO3+H2O
②I2+2Na2S2O3→Na2S4O6+2NaI
实验中,准确称量SeO2样品0.2500g,消耗了0.2000 mol/L的Na2S2O3溶液25.00 mL,所测定的样品中SeO2的质量分数为_ __。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮专题冲刺第3讲 离子反应氧化还原反应练习卷(解析版) 题型:填空题
二氧化硒(SeO2)是一种氧化剂,其被还原后的单质硒可能成为环境污染物,通过与浓HNO3或浓H2SO4反应生成SeO2以回收Se。完成下列填空:
(1)Se和浓HNO3反应的还原产物为NO和NO2,且NO和NO2的物质的量之比为1∶1,写出Se和浓HNO3的反应方程式___________________________________________。
(2)已知:Se+2H2SO4(浓)―→2SO2↑+SeO2+2H2O,2SO2+SeO2+2H2O―→Se+2SO42—+4H+,则SeO2、H2SO4(浓)、SO2的氧化性由强到弱的顺序是______________。
(3)回收得到的SeO2的含量,可以通过下面的方法测定: ①SeO2+KI+HNO3―→Se+I2+KNO3+H2O
②I2+2Na2S2O3―→Na2S4O6+2NaI。配平方程式①,标出电子转移的方向和数目。
(4)实验中,准确称量SeO2样品0.150 0 g,消耗了0.200 0 mol/L的Na2S2O3溶液25.00 mL,所测定的样品中SeO2的质量分数为________。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年贵州省高三第二次月考理科综合化学试卷(解析版) 题型:选择题
凤岗的“富锌富硒”茶现已享誉全国,富含硒元素,有延年益寿、抗衰老等作用。二氧化硒(SeO2)是一种氧化剂,其被还原后的单质硒可能成为环境污染物,通过与浓HNO3、浓H2SO4反应生成SeO2以回收Se。在回收过程当中涉及到如下两个化学反应①SeO2+4KI+4HNO3= Se+2I2+4KNO3+2H2O;② Se+2H2SO4(浓) ==2SO2↑+SeO2+2H2O,下列有关叙述正确的是
A.SeO2、H2SO4(浓)、I2的氧化性由强到弱的顺序是H2SO4(浓)> SeO2> I2。
B.①中Se是氧化产物,I2是还原产物
C.反应①中KI是氧化剂,SeO2是还原剂
D.反应①中每有1.0 mol I2生成,转移电子数目为4NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com