
下列说法正确的是( )
|
| A. | 高温下,可在试管内完成焦炭和石英砂(SiO2)制取硅的反应 |
|
| B. | CO2和钠在一定条件下可以得到金刚石和碳酸钠,反应中氧化剂和还原剂之比是3:4 |
|
| C. | 现代海战通过喷放液体SiCl4(极易水解)和液氨可产生烟幕,其主要成分是NH4Cl |
|
| D. | 从燃煤烟道灰中(含GeO2)提取半导体材料单质锗(Ge),没有发生氧化还原反应 |
| 硅和二氧化硅;氧化还原反应;盐类水解的应用.. | |
| 专题: | 元素及其化合物. |
| 分析: | A.试管自身含有二氧化硅; B.化合价升高和降低的总数相等; C.SiCl4(极易水解)水解后生成硅酸和氯化氢; D.凡是有化合价的升降的反应是氧化还原反应. |
| 解答: | 解:A.试管自身含有二氧化硅,高温条件下可以和焦炭反应,故A错误; B.CO2和钠在一定条件下反应可以得到金刚石和碳酸钠,反应中氧化剂和还原剂的物质的量之比是1:4,故B错误; C.SiCl4(极易水解)水解后生成硅酸和氯化氢,氯化氢易和氨气反应生成氯化铵固体,故C正确; D.由GeO2提取半导体材料单质锗(Ge)有化合价的升降是氧化还原反应,故D错误. 故选C. |
| 点评: | 本题考查硅的化合物的性质,难度中等,注意SiCl4(极易水解)水解后生成硅酸和氯化氢,氯化氢易和氨气反应生成氯化铵固体. |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
五种短周期元素A、B、C、D、E的原子序数依次增大,A和C同族,B和D 同族,C离子和B离子具有相同的电子层结构。A和B、D、E均能形成共价型化合物。A和B形成的化合物在水中呈碱性,C和E形成的化合物在水中呈中性。回答下列问题:
(1)五种元素中,原子半径最大的是 ,非金属性最强的是 (填元素符号);
(2)由A和B、D、E所形成的共价型化合物中,热稳定性最差的是 (用化学式表示);
(3)A和E形成的化合物与A和B形成的化合物反应,产物的化学式为 ,其中存在的化学键类型为 ;
(4)D最高价氧化物的水化物的化学式为 ;
(5)单质D在充足的单质E中燃烧,反应的化学方程式为 ;D在不充足的E中燃烧,生成的主要产物的化学式为 ;
(6)单质E与水反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定条件下A与B反应可生成C和D,其能量变化如图:

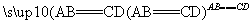

下列有关反应A+B===C+D的说法正确的是 ( )。
A.反应前后原子的种类和数目一定不变
B.反应前后分子的种类和数目一定改变
C.反应物的总能量E1与生成物的总能量E2一定相等
D.此反应一定有热量的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应的离子方程式正确的是( )
|
| A. | 向Fe2(SO4)3溶液中滴入KSCN溶液:Fe3++3SCN﹣⇌Fe(SCN)3↓ |
|
| B. | 向NaHCO3溶液中滴加少量Ca(OH)2溶液:Ca2++OH﹣+HCO3﹣=CaCO3↓+H2O |
|
| C. | 向NaHSO4溶液中滴加Ba(OH)2溶液至呈中性:2H++SO42﹣+Ba2++2OH﹣=2H2O+BaSO4↓ |
|
| D. | 用KIO3氧化酸性溶液中的KI:5I﹣+IO3﹣+3H2O=3I2+6OH﹣ |
查看答案和解析>>
科目:高中化学 来源: 题型:
某硫酸厂废气中SO2的回收利用方案如图所示.下列说法不正确的是( )
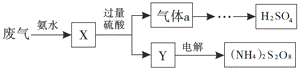
|
| A. | X可能含有2种盐 | B. | a是SO3 |
|
| C. | Y可能含有(NH4)2SO4 | D. | (NH4)2S2O8中S的化合价不可能为+7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
水是生命之源,也是化学反应的主角.试回答下列问题:
P、Q、R是中学化学常见的三种有色物质(其组成元素均属于短周期元素),摩尔质量依次增大,它们均 能与水发生氧化还原反应,但水既不是氧化剂也不是还原剂,请写出P、Q、R与水反应的化学方程式:
(1)P+H2O: ;
(2)Q+H2O: ;
(3)R+H2O: .
查看答案和解析>>
科目:高中化学 来源: 题型:
化学与环境、材料、信息、能源关系密切,下列说法正确的是
A.绿色化学的核心是应用化学原理对环境污染进行治理
B.开发高效氢能、太阳能等新型电动汽车,以解决城市机动车尾气排放问题
C.PM 2.5是指大气中直径接近2.5×10-6m的颗粒物,分散在空气中形成胶体
D.半导体行业中有一句话:“从沙滩到用户”,计算机芯片的材料是二氧化硅
查看答案和解析>>
科目:高中化学 来源: 题型:
某研究小组用黄铁矿(FeS2)、氯酸钠和硫酸溶
液混合反应制备ClO2气体,再用水吸收该气体可得
ClO2溶液。在此过程中需要控制适宜的温度,若温
度不当,副反应增加,影响生成ClO2气体的纯度,
且会影响ClO2的吸收率,具体情况如图所示。
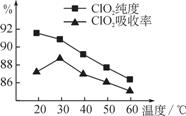
(1)据图可知,反应时需要控制的适宜温度是________℃,
要达到此要求需要采取的措施是 。
(2)已知:黄铁矿中的硫元素在酸性条件下可被ClO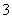 氧化成SO
氧化成SO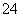 ,请写出FeS2、氯酸钠和硫酸溶液混合反应生成二氧化氯(ClO2)的离子方程式: 。
,请写出FeS2、氯酸钠和硫酸溶液混合反应生成二氧化氯(ClO2)的离子方程式: 。
(3)该小组拟以“m(ClO2)/m(NaClO3)”作为衡量ClO2产率的指标。若取NaClO3样品
6.0 g,通过反应和吸收获得400 mL ClO2溶液,取此溶液20mL与37.00 mL 0.500 mol·L-1 (NH4)2Fe(SO4)2溶液充分反应后,过量的Fe2+再用0.0500 mol·L-1 K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7标准溶液20.00 mL。反应原理为:
4H++ClO2+5Fe2+===Cl-+5Fe3++2H2O
14H++Cr2O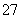 +6Fe2+===2Cr3++6Fe3++7H2O
+6Fe2+===2Cr3++6Fe3++7H2O
试计算ClO2的“产率” (写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
铝是一种重要的金属,在生产、生活中具有许多重要的用途,下图是从铝土矿中制备铝的工艺流程:
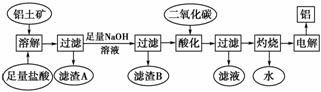
已知: 铝土矿的主要成分是Al2O3,此外还含有少量SiO2、Fe2O3等杂质;回答下列问题:
(1)向铝土矿中加入足量盐酸过滤后所得滤渣A的主要成分为________。
(2)在工艺流程中,加入足量氢氧化钠溶液过程中发生反应的离子方程式为__________________________________________________________________________,
过滤后所得滤渣B的成分为________。用二氧化碳酸化后过滤所得滤液中的溶质是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com