
| A. | 以上四种元素的原子半径大小为WXYZ | |
| B. | X的氢化物与水分子之间可形成氢键 | |
| C. | 已知Z-Cl键能比X-Cl键能小,所以Z的最简单氯化物比X的最简单氯化物沸点低 | |
| D. | W与Y可形成既含共价键又含离子键的化合物 |
分析 X的一种核素在考古时常用来鉴定一些文物的年代,用的是C14,采用的是断代法;工业上采用液态空气分馏方法来生产Y的单质,这是工业上生产氮的方法,Z的原子序数大于X、Y,与X同族,应为Si,W的阴离子的核外电子数与X、Y原子的核外内层电子数相同,所以W是H,结合元素周期律的递变规律解答该题.
解答 解:X的一种核素在考古时常用来鉴定一些文物的年代,用的是C14,采用的是断代法;工业上采用液态空气分馏方法来生产Y的单质,这是工业上生产氮的方法,Z的原子序数大于X、Y,与X同族,应为Si,W的阴离子的核外电子数与X,Y原子的核外内层电子数相同,所以W是H,
A.四种元素的原子半径H的最小,Si的最大,故A错误;
B.X为C元素,对应的氢化物为甲烷等,由于C的非金属性较弱,则不存在氢键,故B错误;
C.C、Si的最简单氯化物都为分子晶体,相对分子质量越大,沸点越高,故C错误;
D.W为H,Y为N,可形成NH4H,为离子化合物,含有离子键、共价键,故D正确.
故选D.
点评 本题考查原子结构与元素周期律的关系,为高频考点,侧重于学生的分析能力的考查,题目难度中等,本题注意正确推断元素的种类为解答该题的关键.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 一定互为同分异构体 | B. | 一定是同系物,有相同的通式 | ||
| C. | 实验式相同 | D. | 只能是同种物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | CH2═CHCH3 | B. | CH3CH═CHCH3 | C. | (CH3)2C═C(CH3)2 | D. | CH3CH2CH═CH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
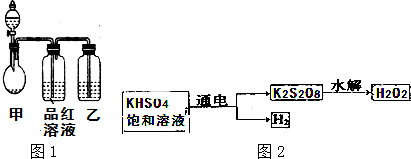
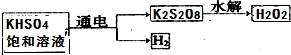
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D | |
| 分子式 | C4H8 | C4H8Cl2 | C4H10O | C5H10O2 |
| 限定条件 | 能发生加成反应 | 只有一个甲基 | 能与钠反应 | 只有一种官能团 |
| 数目 | 3 | 5 | 3 | 2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含氢氧化铁胶粒的分散系中可能大量存在H+,K+,S2-Br- | |
| B. | 高锰酸钾溶液中可能大量存在H+,Na+,SO42-,葡萄糖分子 | |
| C. | 弱碱性溶液中可能大存在Na+,K+,Cl-,HCO3- | |
| D. | 中性溶液中可能大量存在Fe3+,K+,Cl-,SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
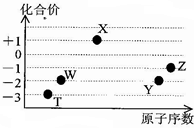 如图是五种短周期元素的原子序数与其在氢化物中化合价的关系图,则下列说法不正确的是( )
如图是五种短周期元素的原子序数与其在氢化物中化合价的关系图,则下列说法不正确的是( )| A. | X的氢化物具有很强的还原性 | |
| B. | YW2、ZW2、X2W2都能使品红溶液褪色,且褪色原理相同 | |
| C. | Y、Z元素的最高价氧化物对应的水化物都呈酸性,而且酸性:HZO4>H2YO4 | |
| D. | 元素W、T的氢化物的沸点比同主族中相邻的氢化物高,是因为这两种氢化物分子间存在氢键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物 质 | 杂 质 | 试剂 | 提 纯 方 法 | |
| A | BaSO4 | BaCO3 | 水 | 溶解、过滤、洗涤 |
| B | CO2 | SO2 | 饱和Na2CO3溶液 | 洗气 |
| C | 乙酸乙酯 | 乙酸 | 稀NaOH溶液 | 混合振荡、静置分液 |
| D | 蛋白质 | 葡萄糖 | 浓(NH4)2SO4溶液 | 溶解、过滤、洗涤 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 弱酸 | H2CO3 | 水杨酸(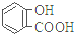 ) ) |
| 电离平衡常数(25℃) | Ka1=4.3×10-7 Ka2=5.6×10-11 | Ka1=1.3×10-3 Ka2=1.1×10-13 |
| A. | 常温下,等浓度、等体积的NaHCO3 溶液pH小于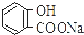 溶液pH 溶液pH | |
| B. | 常温下,等浓度、等体积的Na2 CO3 溶液和 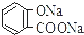 溶液中所含离子总数前者小于后者 溶液中所含离子总数前者小于后者 | |
| C. | 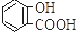 +2NaHCO3→ +2NaHCO3→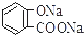 +2H2O+2CO2↑ +2H2O+2CO2↑ | |
| D. | 水杨酸的第二级电离 Ka2 远小于第一级电离Ka1 的原因之一是 能形成分子内氢键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com