
 2C(g)+ D(g)����H<0����һ���¶Ⱥ�ѹǿ�´ﵽƽ�⡣��ƽ��ʱC�����ʵ��������B�����ʵ����ı仯��ϵ��ͼ��ʾ�� ������˵������ȷ����
2C(g)+ D(g)����H<0����һ���¶Ⱥ�ѹǿ�´ﵽƽ�⡣��ƽ��ʱC�����ʵ��������B�����ʵ����ı仯��ϵ��ͼ��ʾ�� ������˵������ȷ����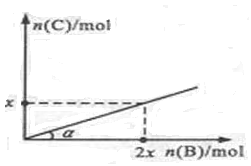
 ���б�ˢ��ϵ�д�
���б�ˢ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2NH3��g������H=��92.4 kJ��mol��1����������ȷ����
2NH3��g������H=��92.4 kJ��mol��1����������ȷ����| A���ﵽ��ѧƽ��ʱ���������¶ȣ�������Ӧ���ʼ�С���淴Ӧ�������� |
| B������λʱ��������x mol N2��ͬʱ����2x mol NH3����Ӧ�ﵽƽ��״̬ |
| C���ﵽƽ������������СΪԭ����һ�룬���´ﵽƽ���c��NH3����Ϊԭƽ��ʱ��2�� |
| D�����ﵽƽ��ʱ�����ų�46.2kJ����������l mo1NH3��g������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 CO(g) + H2O(g)��
CO(g) + H2O(g)���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 3C��g��+D��g�������²���˵���Ѵ�ƽ��״̬����
3C��g��+D��g�������²���˵���Ѵ�ƽ��״̬����| A����Ӧ�����У�ѹǿ����ʱ��ı���ı� |
| B����λʱ��������3nmolC��ͬʱ����nmolA |
| C����Ӧ�����У���������ƽ����Է����������ٸı� |
| D����Ӧ�����е������ܶȲ���ʱ��仯 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 I(aq)���÷�Ӧ��ƽ�ⳣ�����¶ȵĹ�ϵ��ͼ������˵������ȷ����( )
I(aq)���÷�Ӧ��ƽ�ⳣ�����¶ȵĹ�ϵ��ͼ������˵������ȷ����( )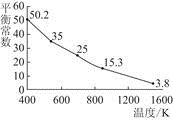
| A����������ӦΪ���ȷ�Ӧ |
| B��������ϵ�м��뱽��ƽ�ⲻ�ƶ� |
| C�������ø÷�Ӧԭ����ȥ����������ĵⵥ�� |
| D��ʵ�������Ƶ�ˮʱ��Ϊ����ⵥ�ʵ��ܽ�ȿɼ�������KI��Һ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 Ni(CO)4��g������֪�÷�Ӧƽ�ⳣ�����¶ȵĹ�ϵ�±�������˵����ȷ����
Ni(CO)4��g������֪�÷�Ӧƽ�ⳣ�����¶ȵĹ�ϵ�±�������˵����ȷ����| �¶ȡ� | 25 | 80 | 230 |
| ƽ�ⳣ�� | 5��104 | 2 | 1.9��10-5 |
 Ni��s��+4CO��g����ƽ�ⳣ��Ϊ0.5
Ni��s��+4CO��g����ƽ�ⳣ��Ϊ0.5�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2NH3(g) ��H����92��4 kJ��mol
2NH3(g) ��H����92��4 kJ��mol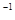 ����
����| | ��Ӧ��Ͷ���� | NH3��Ũ�� ��mol��L 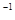 �� �� | ��Ӧ�� �����仯 | ��ϵѹǿ ��Pa�� | ��Ӧ�� ת���� |
| �� | 1mol N2��3mol H2 | c1 | �ų�a kJ | p1 | ��1 |
| �� | 2mol NH3 | c2 | ����b kJ | p2 | ��2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
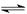 2Z(g)����H��0��Ϊ��ʹƽ��������Z�ķ����ƶ���Ӧѡ���������( )
2Z(g)����H��0��Ϊ��ʹƽ��������Z�ķ����ƶ���Ӧѡ���������( )| A���٢ۢ� | B���ڢۢ� | C���ڢۢ� | D���ڢܢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 PCl3(g)��Cl2(g) ��
PCl3(g)��Cl2(g) �� H2(g)��I2(g) ��
H2(g)��I2(g) �� N2O4(g) ��
N2O4(g) ��| A�������� |
| B�������� |
| C�������ڲ��䣬�ۼ��� |
| D���ټ��٣��ڲ��䣬������ |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com