
| A、海水的淡化,只需经过化学变化就可以得到 | B、海水蒸发制海盐的过程中只发生了化学变化 | C、从海水中可以得到NaCl,电解熔融NaCl可制备金属Na | D、利用海水、铝、空气的航标灯的原理是将电能转化为化学能 |


科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:

| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、海水蒸发制海盐的过程只发生了化学变化 | B、海水中含有钾元素,只需要经过物理变化就可以得到钾单质 | C、利用潮汐发电是将化学能转化为电能 | D、从海水中提取溴单质的过程涉及氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源:2013-2014学年甘肃省天水市秦安县高三上学期期末检测化学试卷(解析版) 题型:填空题
海洋是巨大的化学资源宝库。下面是海水化学资源综合利用的部分流程图:
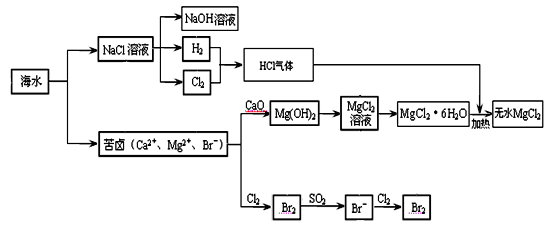
回答:
(1)由海水晒制的粗盐中含有Ca2+、Mg2+、SO42-等离子,为了除去这些离子,需要依次加入稍过量的NaOH、BaCl2、__ ___(填试剂化学式),然后__ ___(填操作名称)。在溶液中再加适量 (填试剂),加热蒸干溶液即得到精盐。
(2)某同学在实验室模拟氯碱工业的生产原理电解饱和食盐水。用玻璃棒蘸浓氨水检验阳极产生的气体,发现产生大量白烟。阳极生成的气体是 ,白烟的主要成分是 。
(3)制取MgCl2的过程中涉及反应:MgCl2·6H2O MgCl2 + 6H2O,该反应要在HCl气流中进行,原因是 。
MgCl2 + 6H2O,该反应要在HCl气流中进行,原因是 。
(4)苦卤中通入Cl2置换出Br2,吹出后用SO2吸收转化为Br-,反复多次,以达到富集溴的目的。由海水提溴过程中的反应可得出Cl-、SO2、Br-还原性由强到弱的顺序是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
海水是巨大的化学资源宝库,下列有关海水综合利用的说法正确的是
A.海水中含有钾元素,只需经过物理变化就可以得到钾单质
B.海水蒸发制海盐的过程中主要是物理变化
C.从海水中可以得到NaCl,电解熔融NaCl可制得Cl2
D.利用潮汐发电是将化学能转化为电能
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com