
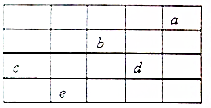
 如图所示,a、b、c、d、e为周期表前4周期的一部分元素,下列叙述正确的是( )
如图所示,a、b、c、d、e为周期表前4周期的一部分元素,下列叙述正确的是( )| A. | b元素除0价外,只有一种化合价 | |
| B. | 五种元素中,c元素的天然氧化物可被称为刚玉 | |
| C. | b、d气态氢化物溶于水,溶液的酸性:b>d | |
| D. | c、d气态氢化物的稳定性:d>c |
分析 a、b、c、d、e为周期表前4周期的元素,由元素在周期表中位置,可知a为He、b为O、c为Si、d为Cl、e为As.
A.O元素除0价外,还有-1、-2;
B.c元素的天然氧化物可被称为硅石、水晶、石英等;
C.b、d的氢化物为水、HCl,水为中性,HCl溶液呈酸性;
D.非金属性越强,氢化物越稳定.
解答 解:a、b、c、d、e为周期表前4周期的元素,由元素在周期表中位置,可知a为He、b为O、c为Si、d为Cl、e为As.
A.O元素除0价外,还有-1、-2,故A错误,
B.c元素的天然氧化物可被称为硅石、水晶、石英等,刚玉是氧化铝,故B错误;
C.b、d的氢化物为水、HCl,水为中性,HCl溶液呈酸性,故C错误;
D.非金属性d(Cl)>c(Si),非金属性越强,氢化物越稳定,故D正确,
故选D.
点评 本题考查结构性质位置关系应用,难度不大,注意整体把握元素周期表的结构.


 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 某元素基态原最外层有3个未成对电子,最内层有2个电子,其元素符号为N | |
| B. | 某元素的负一价离子的电子层结构与氩相同,其基态原子价电子排布式为[Ne]3s23p5 | |
| C. | 某元素的正三价离子的3d能级为半充满,其基态原子排布式为[Ar]3d64s2 | |
| D. | 某元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,其基态原子的电子排布式为[Ar]3d54s1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子中碳原子不在一条直线上 | B. | 光照不能够发生取代反应 | ||
| C. | 是石油分馏的一种产品 | D. | 比丁烷更易液化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| A组 | B组 | C组 | D组 |
| 金刚石:3110℃ | Li:181℃ | HF:-83℃ | NaCl:801℃ |
| 硅晶体:1410℃ | Na:98℃ | HCl:-114℃ | KCl:776℃ |
| 硼晶体:2300℃ | K:64℃ | HBr:-89℃ | RbCl:718℃ |
| 二氧化硅:1723℃ | Rb:39℃ | HI:-51℃ | CsCl:645℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
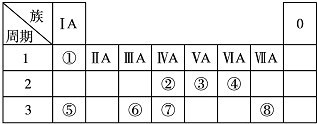
 ,
,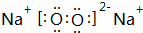 .若用球棍模型表示①和④形成的化合物的分子结构,应该是下图中的B.
.若用球棍模型表示①和④形成的化合物的分子结构,应该是下图中的B.
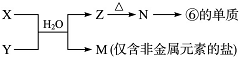
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 属于芳香烃 | B. | 分子中苯环上的一氯代物有3种 | ||
| C. | 不能与金属钠发生反应 | D. | 不能发生水解反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com