
分析 化合价发生改变的反应一定是氧化还原反应,置换反应的化合价一定发生了改变,一定属于氧化还原反应,复分解反应前后元素化合价一定不变,一定不属于氧化还原反应结合四大基本反应类型的概念来回答.
解答 解:A、反应2KClO3$\stackrel{MnO_{2}△}{→}$2KCl+3O2↑反应物有一种,生成物有多种属于分解反应,存在化合价的变化,属于氧化还原反应;
B、反应2Fe+3Cl2$\stackrel{点燃}{→}$2FeCl3的反应物两种,生成物只有一种,属于化合反应,该反应中存在化合价的变化,属于氧化还原反应;
C、反应NH4HCO3$\stackrel{△}{→}$NH3↑+H2O+CO2↑ 反应物有一种,生成物有多种属于分解反应,不存在化合价的变化,不属于氧化还原反应;
D、反应CaO+CO2=CaCO3的反应物两种,生成物只有一种,属于化合反应,该反应不存在化合价的变化,不属于氧化还原反应;
E.反应Cl2+H2O?HCl+HClO中存在元素化合价的变化,是氧化还原反应,不属于四大基本反应类型;
故答案为:A;C;B;D;E.
点评 本题考查学生四大基本反应类型以及氧化还原反应的概念和联系,准确理解概念是解题的关键,难度不大.


 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
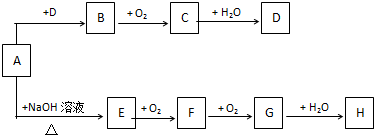
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化铝加到热水中 | B. | NaAlO2溶液中加入足量盐酸 | ||
| C. | 铝投入氨水中 | D. | NaOH滴入足量AlCl3溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
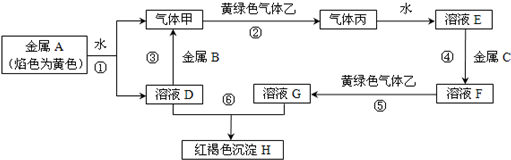
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
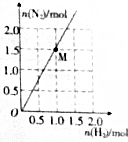 肼是一种优良的贮氢材料,在高温下,N2H4可完全分解为NH3、N2及H2,实验测得分解产物中N2与H2的物质的量的关系如图所示.若该反应中每转移1mol电子吸收30kJ热量,则图中M点时反应吸收的热量为( )
肼是一种优良的贮氢材料,在高温下,N2H4可完全分解为NH3、N2及H2,实验测得分解产物中N2与H2的物质的量的关系如图所示.若该反应中每转移1mol电子吸收30kJ热量,则图中M点时反应吸收的热量为( )| A. | 120kJ | B. | 180kJ | C. | 240kJ | D. | 360kJ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com