
【题目】如图实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:

(1)该浓盐酸中HCl的物质的量浓度为_____ mol/L。
(2)取用任意体积的该盐酸溶液时,下列物理量中不随所取体积的多少而变化的是___。
A.溶液中HCl的物质的量 B.溶液的浓度 C.溶液中Cl-的数目 D.溶液的密度
(3)某学生欲用上述浓盐酸和蒸馏水配制500 mL物质的量浓度为0.400 mol/L的稀盐酸。该学生需要量取___mL上述浓盐酸进行配制。
(4)①假设该同学成功配制 了0.400 mol/L的盐酸,他又用该盐酸中和含0.4 g NaOH的NaOH溶液,则该同学需取____ mL盐酸。
②假设该同学用新配制的盐酸中和含0.4 g NaOH的NaOH溶液,发现比①中所求体积偏小,则可能的原因是_____。
A.浓盐酸挥发,浓度不足 B.配制溶液时,未洗涤烧杯
C.配制溶液时,俯视容量瓶刻度线 D.加水时超过刻度线,用胶头滴管吸出
【答案】11.9 B、D 16.8 25 C
【解析】
(1)根据物质的量浓度c=![]() 来计算;
来计算;
(2)根据该物理量是否与溶液的体积有关判断;
(3)设所需的浓盐酸的体积为VmL,根据溶液稀释定律c浓V浓=c稀V稀来计算;
(4)①根据n(HCl)=n(NaOH)计算;
②盐酸体积减少,说明标准液盐酸体积读数减小,逐项分析即可。
(1)盐酸溶液的物质的量浓度c=![]() =
=![]() mol/L=11.9;
mol/L=11.9;
(2)A.溶液中HCl的物质的量=cV,所以与溶液的体积有关,故A错误;
B.溶液的浓度c=![]() ,与溶液的体积无关,故B正确;
,与溶液的体积无关,故B正确;
C.溶液中Cl-的数目=nNA=cVNA,所以与溶液的体积有关,故C错误;
D.溶液的密度与溶液的体积无关,故D正确;
故选BD;
(3)设所需的浓盐酸的体积为VmL,根据溶液稀释定律c浓V浓=c稀V稀可知:11.9mol/L×VmL=0.4mol/L×500mL,解得V=16.8mL;
(4)①n(HCl)=n(NaOH)=0.4g÷40g/mol=0.01mol,V(HCl)=![]() =0.025L=25mL;
=0.025L=25mL;
②消耗的标准液盐酸体积减少,说明读数时标准液的体积比实际体积减少了,则
A.浓盐酸挥发,浓度不足,配制的标准液浓度减小,滴定时消耗盐酸体积变大,故A错误;
B.配制溶液时,未洗涤烧杯,标准液浓度减小,消耗体积增大,故B错误;
C.配制溶液时,俯视容量瓶刻度线,配制的标准液浓度变大,滴定时消耗的体积减小,故C正确;
D.加水时超过刻度线,用胶头滴管吸出,标准液浓度减小,滴定时消耗标准液体积增大,故D错误;
故答案为C。


科目:高中化学 来源: 题型:
【题目】某同学用某种粗盐进行提纯实验,步骤见下图.

请回答:
(1)步骤①和②的操作名称是________.
(2)步骤③判断加入盐酸“适量”的方法是_____;
步骤④加热蒸发时要用玻璃棒不断搅拌,这是为了防止___________,当蒸发皿中有较多量固体出现时,应___________,用余热使水分蒸干.
(3)猜想和验证:
猜想 | 验证的方法 | 现象 | 结论 |
猜想Ⅰ:固体A中含 CaCO3、MgCO3 | 取少量固体A于试管中,滴加稀盐酸,并用涂有澄清石灰水的小烧杯罩于试管口 | _____ | 猜想Ⅰ成立 |
猜想Ⅱ:固体A中含 BaCO3 | 取少量固体A于试管中,先滴入________,再滴入Na2SO4溶液 | 有气泡放出,无白色沉淀 | ______ |
猜想Ⅲ:最后制得的NaCl晶体中还含有Na2SO4 | 取少量NaCl晶体溶于试管中的蒸馏水,________ | _____ | 猜想Ⅲ成立 |
请写出猜想Ⅲ验证过程中发生的化学反应方程式_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实中,能说明氯的非金属性比硫强的是( )
A.次氯酸(HClO)的酸性比硫酸强
B.次氯酸的氧化性比稀硫酸强
C.氯化氢比硫化氢的热稳定性好
D.最外层电子数氯原子的比硫原子的多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种重要的试剂,氢气和二氧化碳在一定条件下可合成甲醇:CO2(g)+3H2 (g) ![]() CH3 OH(g)+H2O(g),在密闭容器中充入3mol氢气和1mol二氧化碳,测得混合气体中甲醇的体积分数与温度的关系如图A所示:
CH3 OH(g)+H2O(g),在密闭容器中充入3mol氢气和1mol二氧化碳,测得混合气体中甲醇的体积分数与温度的关系如图A所示:

试回答下列问题:
(1)该反应是______(填“放热”或“吸热”)反应。该反应平衡常数的表达式是:______,为了降低合成甲醇的成本可采用的措施是______(任意写一条合理的建议)
(2)解释0~T0内,甲醇的体积分数变化趋势:______。
(3)氢气在Q点的转化率______(填“大于”、“小于”或“等于”,下同)氢气在W点的转化率______;其它条件相同,甲醇在Q点的正反应速率______甲醇在M点的正反应速率。
(4)图B表示氢气转化率α(H2)与投料比![]() 的关系,请在图B中画出两条变化曲线并标出曲线对应的条件,两条曲线对应的条件分别为:一条曲线对应的压强是1.01×105Pa;另一条曲线对应的压强是3.03×105Pa(其它条件相同)
的关系,请在图B中画出两条变化曲线并标出曲线对应的条件,两条曲线对应的条件分别为:一条曲线对应的压强是1.01×105Pa;另一条曲线对应的压强是3.03×105Pa(其它条件相同)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验是化学研究的一种重要手段,现有如图所示A~E五种仪器,请根据要求填空。

(1)写出仪器名称:C__________,E_________。
(2)下列实验操作中用到仪器E的是___________(填字母)。
a.分离水和CCl4的混合物
b.分离水和酒精的混合物
c.分离水和泥沙的混合物
d.分离NaCl溶液中的NaCl和水
(3)仪器A~E中使用前必须检查是否漏水的是_________。
(4)若利用下图装置分离四氯化碳和酒精的混合物,则还缺少的仪器是____________,加热前应先在圆底烧瓶中加入几粒沸石,目的是_________________________;冷凝管的进水口是________(填“f”或“g”)。
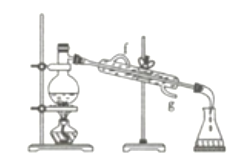
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上可用甲烷和氧气按9:1的体积比混合,在200℃和10MPa的条件下,通过铜制管道反应制得甲醇:2CH4+O2=2CH3COH。
(1)已知一定条件下,CH4和CH3COH燃烧的热化学方程式分别为:
CH4(g)+SO2(g)=CO2(g)+2H2(g) △H=-802kJ/lmol
CH3OH(g)+l.5O2(g)=CO2(g)+2H2O(g) △H=-677kJ/mol
则2CH4(g)+O2(g)=2CH3OH(g) △H=__________
(2)甲烷固体氧化物燃料电池属于第三代燃料电池,是一种在中高温下直接将储存在燃料和氧化剂中的化学能高效、环境友好地转化成电能的全固态化学发电装置。其工作原理如下图所示。a是电池的____极(填“正”或“负”) ,b极的电极反应式为__________。

(3)工业上合成甲醇的另一种方法为:
CO(g)+2H2(g) ![]() CH3OH(g) △H=-90kJ/mol
CH3OH(g) △H=-90kJ/mol
T℃时,将2mol CO 和4molH2充入1L 的密闭容器中,测得H2的物质的量随时间变化如下图实线所示。
① 能用于判断反应已达化学平衡状态的是____________。
A.气体的总压强不再改变
B. H2与CH3OH的体积比不再改变
C.气体的密度不再改变
D.单位时间内消耗1mol CO,同时生成1mol CH3OH
② 请计算出T℃ 时反应的平衡常数K=_________________。
③ 仅改变某一实验条件再进行两次实验测得H2的物质的量随时间变化如图中虚线所示。曲线Ⅰ对应的实验条件改变是:________;曲线Ⅱ对应的实验条件改变是_________0。

④ a、b、c三点逆反应速率由大到小排列的顺序是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欲用含有少量氯化钙的氯化钠固体,配制100 mL a mol/L的氯化钠溶液,设计了下面的操作方案。根据方案操作步骤回答下列问题:
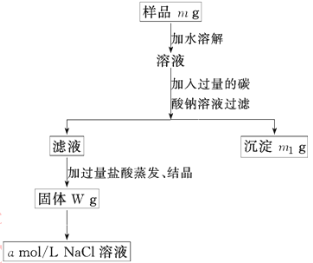
(1)称量粗盐样品m g,在托盘天平左盘上放_____,右盘上放_____。
(2)过滤时,漏斗下端管口应_____,漏斗里液面应_______。
(3)蒸发操作时应将液体放在___中加热,等加热至____时即停止加热。
(4)在样品的溶液中加入过量的Na2CO3溶液,作用是_______,反应的化学方程式是_______。
(5)在滤液中加入盐酸的作用是_______,反应的化学方程式是_____。
(6)配制80 mL a mol/L的NaCl溶液时,应从W g固体中称取NaCl的质量为_____,配制时应在____中进行定容。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰氯(NOCl)是一种红褐色液体或黄色气体,其熔点64.5℃,沸点5.5℃,遇水易水解。它是有机合成中的重要试剂,可由NO与Cl2在常温常压下合成。
(1)实验室制备原料气NO和Cl2的装置如下图所示:
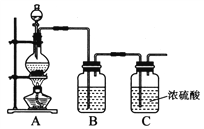
实验室制Cl2时,装置A中烧瓶内发生反应的化学方程式为_______。装置B中盛放的试剂为_______,其作用为___________________。
(2)将上述收集到的Cl2充入D的集气瓶中,按图示装置制备亚硝酰氯。

①NOCl分子中各原子均满足8电子稳定结构,则NOCl的电子式为_______。
②装置D中发生的反应方程式为__________________。
③如果不用装置E会引起什么后果______________________。
④某同学认为装置F不能有效吸收尾气中的某种气体,该气体为_____,为了充分吸收尾气,可将尾气与_______同时通入氢氧化钠溶液中。
(3)工业上可用间接电化学法除去NO,其原理如下图所示,吸收塔中发生的反应为:NO+S2O42+H2O→N2+HSO3

①吸收塔内发生反应的氧化剂与还原剂物质的量之比为_________________。
②阴极的电极反应式为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】食醋是常用的食品酸味剂,其主要成分是乙酸。下列有关乙酸说法不正确的是( )
A.乙酸易溶于水
B.食醋可由粮食酿造
C.乙酸可与苏打反应
D.乙酸不易挥发
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com