

分析 A装置中碳酸钙和稀硝酸反应生成硝酸钙、二氧化碳和水,硝酸具有挥发性,导致生成的二氧化碳中含有硝酸,硝酸也能和硅酸钠反应生成硅酸,从而影响碳酸酸性强弱判断,用B中碳酸氢钠吸收硝酸,C中二氧化碳、水和硅酸钠反应生成硅酸,根据强酸制取弱酸来判断硝酸、碳酸、硅酸酸性强弱;
(1)碳酸钙和稀硝酸反应生成硝酸钙、二氧化碳和水;二氧化碳、水和硅酸钠反应生成难溶性的硅酸;
(2)硝酸、碳酸都能和硅酸钠反应生成硅酸,从而硝酸影响碳酸检验;
(3)根据强酸制取弱酸判断酸性强弱,元素的最高价氧化物的水化物酸性越强,其非金属性越强.
解答 解:A装置中碳酸钙和稀硝酸反应生成硝酸钙、二氧化碳和水,硝酸具有挥发性,导致生成的二氧化碳中含有硝酸,硝酸也能和硅酸钠反应生成硅酸,从而影响碳酸酸性强弱判断,用B中碳酸氢钠吸收硝酸,C中二氧化碳、水和硅酸钠反应生成硅酸,根据强酸制取弱酸来判断硝酸、碳酸、硅酸酸性强弱;
(1)碳酸钙和稀硝酸反应生成硝酸钙、二氧化碳和水,离子方程式为CaCO3+2H+=Ca2++CO2↑+H2O;二氧化碳、水和硅酸钠反应生成难溶性的硅酸,所以C中看到的现象是溶液变浑浊,
故答案为:CaCO3+2H+=Ca2++CO2↑+H2O;溶液变浑浊;
(2)硝酸、碳酸都能和硅酸钠反应生成硅酸,从而硝酸影响碳酸检验,碳酸氢钠能和稀硝酸反应生成二氧化碳,从而除去二氧化碳中存在的硝酸,故答案为:除去二氧化碳中混有的硝酸蒸气;
(3)A中硝酸制取碳酸、C中碳酸制取硅酸,所以这三种酸的强弱顺序是HNO3>H2CO3>H2SiO3,元素的最高价氧化物的水化物酸性越强,其非金属性越强,所以非金属性强弱顺序是N>C>Si,
故答案为:HNO3>H2CO3>H2SiO3;N>C>Si.
点评 本题以实验为载体考查非金属性强弱判断,为高频考点,侧重考查学生实验探究、分析判断及总结归纳能力,注意A中生成的二氧化碳中含有硝酸,如果没有B装置则C中现象不能判断碳酸酸性强弱硅酸,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 合成氨工业:温度控制在500℃左右 | |
| B. | 接触法制硫酸:SO2在常压下催化氧化 | |
| C. | 侯氏制碱法:往母液中继续加入食盐和氨气 | |
| D. | 石油化工:将分馏得到的重油在高温下裂化 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 编号 | ① | ② | ③ | ④ |
| 装置 | 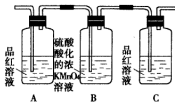 |  |  |  |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子间作用力 | B. | 氢键 | C. | 非极性共价键 | D. | 极性共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合气体的密度不变 | |
| B. | 混合气体的颜色不再改变 | |
| C. | 正反应速率与逆反应速率相等均为零 | |
| D. | 反应物与生成物浓度相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硅晶体是一种重要的半导体材料,在常温下,单质硅易与氧气反应,所以自然界中不存在游离态的硅.石墨烯作为目前发现的最薄、强度最大、导电导热性能最强的一种新型纳米材料,最有潜力的应用是成为硅的替代品用来生产未来的超级计算机 | |
| B. | 电解水制氢比光催化还原水制氢更节能环保、更经济 | |
| C. | 为迎接G20峰会,全温州市努力植树造林,节能减排防治PM2.5,PM2.5是指大气中直径小于或等于2.5纳米的可吸入颗粒物 | |
| D. | 某些铝硅酸盐形成的分子筛中有许多笼状空穴和通道,常用于分离、提纯气体或液体混合物,还可作干燥剂、离子交换剂、催化剂及催化剂载体等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 932kJ | B. | 859 kJ | C. | 538 kJ | D. | 496kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 编号 | 实验操作 | 现象 |
| 步骤1 | 向酸化的FeSO4溶液中加入KSCN溶液 | 溶液几乎无色 |
| 步骤2 | 取步骤1中反应液少量,加入少量PbO2,充分反应 | 溶液变红 |
| 步骤3 | 取步骤2中反应液少量,加入足量Pb,充分反应 | 红色褪去 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子总数为NA的SO2和CO2的混合气体中含有的氧原子数为2NA | |
| B. | 0.1mol/L(NH4)2SO4溶液与0.2mol/LNH4Cl溶液中的NH4+数目相同 | |
| C. | 标准状况下,H2和CO混合气体8.96L在足量O2中充分燃烧消耗O2分子数为0.2NA | |
| D. | 1molNa与足量O2反应生成了混合物,Na失去NA个电子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com