
 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源: 题型:选择题

| A. | 粗盐可采用除杂和重结晶等过程提纯 | |
| B. | 向苦卤中通入Cl2 是为了提取溴 | |
| C. | 实际生产中常选用Ca(OH)2作为沉淀剂 | |
| D. | 工业生产中电解熔融氧化镁的方法制取镁 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 饱和Na2CO3溶液 | B. | Cu(OH)2悬浊液 | C. | 烧碱溶液 | D. | 碘水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题

| A. | A、B、C三种物质中A的溶解度最大 | |
| B. | 通过蒸发溶剂的方法可将C从不饱和溶液变成饱和溶液 | |
| C. | 20℃时,100g水中溶解30g A可达到饱和 | |
| D. | 80℃时,100g水不能将50g B溶解完全,而能完全溶解50g C |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C11H24、C27H56、C29H60三种物质互为同系物 | |
| B. | C33H68在常温下为液态 | |
| C. | C35H72中氢原子被氯气取代,最多需氯气35mol | |
| D. | 正二十一烷分子中所有碳原子在一条直线上 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


| 离子 | 离子半径(pm) | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe2+ | 74 | 7.6 | 9.7 |
| Fe3+ | 64 | 2.7 | 3.7 |
| Al3+ | 50 | 3.8 | 4.7 |
| Mn2+ | 80 | 8.3 | 9.8 |
| Pb2+ | 121 | 8.0 | 8.8 |
| Ca2+ | 99 | - | - |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
. ;
; .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
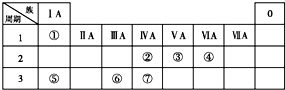 下表为元素周期表的一部分,请参照①~⑦相关元素在表中的位置,用化学用语回答下列问题:
下表为元素周期表的一部分,请参照①~⑦相关元素在表中的位置,用化学用语回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com