
����Ŀ������������Ҫ�ɷ���Al2O3 �� ��SiO2��Fe2O3��MgO�����ʣ�����ȡ�����������ֹ���������ͼ��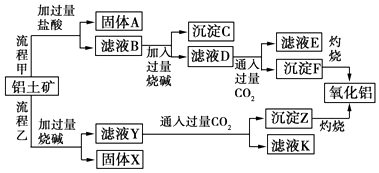
��ش��������⣺
��1��д�����̼����漰�����ӷ���ʽΪ���� ��
��2�������Ҽ����ռ��Al2O3������Ӧ�����ӷ���ʽΪ ��
��3������C����Ҫ�ɷ��� �� ��ȥ����C�IJ����� ��
��4����ҺD�����ʵ���Ҫ�ɷ������ѧʽ����д������ҺD��ͨ�����CO2������Ӧ�����ӷ���ʽ ��
��5���������У�ѡ��CO2���ữ�����ܲ������������CO2 ����ԭ���� ��
���𰸡�
��1��Al2O3+6H+�T2Al3++3H2O,Fe2O3+6H+�T2Fe3++3H2O,MgO+2H+�TMg2++H2O
��2��Al2O3+2OH���T2AlO2��+H2O
��3��Mg��OH��2��Fe��OH��3,����
��4��NaAlO2,AlO2��+CO2+2H2O=Al��OH��3��+HCO3��
��5������,��Ϊ������������Al��OH��3��Ӧ����AlCl3������AlO2��+4H+�TAl3++2H2O��
���������⣺�ɹ������̼�֪����������Ҫ�ɷ���Al2O3����SiO2��Fe2O3��MgO�����ʣ��������������ᷴӦ�ù���AΪ��ҺB�������AΪSiO2����ҺB�����Ȼ������Ȼ������Ȼ�þ�ȣ���Һ�м��������NaOH������֪����CΪ����������������þ����ҺD����ƫ�����ơ��Ȼ��ơ�NaOH����������ҺD��ͨ�����������̼��������������������̼�����ƣ�����FΪAl��OH��3����ҺE�к���NaCl��NaHCO3��
���ݹ��������ҿ�֪���������е�Al2O3��SiO2�ܺ��������Ʒ�Ӧ����֪����XΪFe2O3��MgO�ȣ���ҺYΪ�����ơ�ƫ�����ƣ���Һ��ͨ�����������̼������ZΪAl��OH��3�����ᣬ��ҺK�к���NaHCO3��
��1������������������MgO�ֱ���ᷴӦ�����κ�ˮ�����ӷ���ʽ�ֱ�ΪAl2O3+6H+�T2Al3++3H2O��Fe2O3+6H+�T2Fe3++3H2O��MgO+2H+�TMg2++H2O��
���Դ��ǣ�Al2O3+6H+�T2Al3++3H2O��Fe2O3+6H+�T2Fe3++3H2O��MgO+2H+�TMg2++H2O��
��2��������������������Һ��Ӧ����ƫ�����ƺ�ˮ�����ӷ���ʽΪAl2O3+2OH���T2AlO2��+H2O��
���Դ��ǣ�Al2O3+2OH���T2AlO2��+H2O��
��3������C�ijɷ���Mg��OH��2��Fe��OH��3�����������Թ������Һ���ù��˷��������Գ�ȥ����C���ù��˷�����
���Դ��ǣ�Mg��OH��2��Fe��OH��3�����ˣ�
��4����ҺD������ΪNa AlO2��ƫ�����ƺ���������̼��Ӧ������������������̼�����ƣ����ӷ���ʽΪAlO2��+CO2+2H2O=Al��OH��3��+HCO3����
���Դ��ǣ�NaAlO2�� AlO2��+CO2+2H2O=Al��OH��3��+HCO3����
��5����������������̼����Һ��������ϡ���ᣬ�����Ȼ��������Բ�����ϡ������������̼��
���Դ��ǣ����ܣ���Ϊ������������Al��OH��3��Ӧ����AlCl3������AlO2��+4H+�TAl3++2H2O����


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ӵ����ɳ����ĸ���ԭ������һ���¶Ⱥ�ѹǿ�� (����)
A.��������Ĵ�Сֻ����������Ķ��ٶ��仯
B.��ͬ������ӵĴ�С�������
C.��ͬ������Ӽ��ƽ�����뼸�����
D.������Ӽ��ƽ����������ӱ����Ĵ�С������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����к�NaCl��Na2SO4��NaNO3�Ļ����Һ��ѡ���ʵ����Լ�����ת��Ϊ��Ӧ�ij�������壬�Ӷ�ʵ��Cl����SO![]() ��NO
��NO![]() ������롣��Ӧ��ʵ����̿�����ͼ��ʾ��
������롣��Ӧ��ʵ����̿�����ͼ��ʾ��
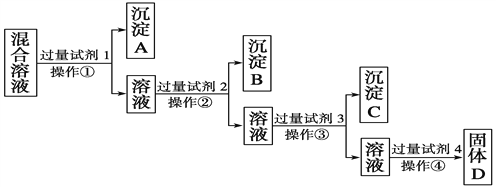
(1)д������ʵ������������Լ������ƣ��Լ�1Ϊ______________���Լ�2Ϊ______________��
(2)�����Լ�4�ļ������ķ�����__________________________��
(3)��������Լ�3��Ŀ����__________________________________��
(4)�����ٵ�������________���ڼ����Լ�4��ù���D��ʵ���������______________________(���������)��
(5)д�������Լ�4������Ӧ�Ļ�ѧ����ʽ��
__________________________________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ƽ�����ʢ��ǿ��ԭ��Һ̬�£�N2H4����ǿ������Һ̬˫��ˮ������0.4molҺ̬�º�0.8mol H2O2��Ϸ�Ӧ�����ɵ�����ˮ�������ų�256.7kJ���������൱��25�桢101kPa�²�õ���������
��1����Ӧ���Ȼ�ѧ����ʽΪ ��
��2������֪H2O��l��=H2O��g����H=+44kJ/mol����16gҺ̬����Һ̬˫��ˮ��Ӧ����Һ̬ˮʱ�ų���������kJ��
��3���˷�Ӧ���ڻ���ƽ������ͷŴ����ȺͿ��ٲ������������⣬����һ���ܴ���ŵ��� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ѧ֪ʶ������ش��������⣺
��1�����������Ų�Ϊ4s24p1��ԭ�ӵĺ˵����Ϊ �� ijԪ�ر���ѧ�ҳ�֮Ϊ������Ԫ���еġ�����֮��������ԭ�ӵ���Χ�����Ų���4s24p4 �� ��Ԫ�ص������� ��
��2������VSEPRģ�ͣ�PO43���ķ�������ṹΪ�����Ҵ�������ˮ��ԭ������HClO4������ǿ��HClO��ԭ������
��3�����Ȼ���������Ϊ���壬�۵�282�棬�е�315�棬��300��������������������ˮ��Ҳ���������ѡ���ͪ���л��ܼ����ݴ��ж����Ȼ�������Ϊ ��
��4��ijԪ�غ������������Ӳ㣬�����������Ǻ������������ ![]() ��д����Ԫ��ԭ�ӵĵ����Ų�ʽ�� �� д����Ԫ�������ڱ��е�λ�� �� ��λ������
��д����Ԫ��ԭ�ӵĵ����Ų�ʽ�� �� д����Ԫ�������ڱ��е�λ�� �� ��λ������
��5����ͼ���Ȼ�菉���ľ���ʾ��ͼ����������С���ظ��ṹ��Ԫ������֪������2�������Cs+�˼��Ϊa pm���Ȼ�藍�CsCl������Է�������M��NAΪ����٤�����������Ȼ�菉�����ܶ�Ϊg/cm3 �� 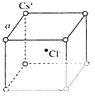
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����л�ѧ������������ǣ� ��
A.�������ʵ��ʽ��CH2
B.���Ȼ�̼���ӵ����ģ �ͣ� ![]()
C.HCl�ĵ���ʽ�� ![]()
D.��ԭ�ӵĽṹʾ��ͼ�� ![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ѧ�����������������������������ֱ��������һ��ּ����
A.�������磬����Դ�����B.�ϳɹ��ˣ���ͨѶ�����
C.�ϳ�ҩ������������D.����Ϳ�ϣ��û������˾�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������OH�����Ӿ�����ͬ������������ͬ�ĵ���������������Ϊ
A.F��B.Mg2��C.NH4��D.CH4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��G�Ǽ������ķ������ģ�ͣ���ͼ�� 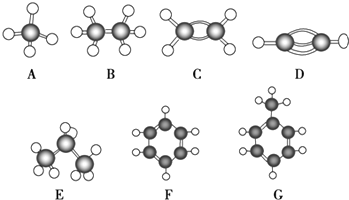
�ݴ˻ش��������⣺
��1�������º�̼����ߵ���̬���������Ӧ��ĸ����
��2���ܹ������ӳɷ�Ӧ�����У������֣��֣�
��3��һ±�������������ǣ����Ӧ��ĸ�� ��
��4��д��ʵ������ȡC�Ļ�ѧ����ʽ ��
��5��д��F���������Ӧ�Ļ�ѧ����ʽ ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com