
【题目】溶液中的化学反应大多是离子反应。根据要求回答下列问题:
(1)Na2CO3溶液显碱性的原因,用离子反应方程式表示_____________________________;CuSO4溶液呈酸性的原因,用离子反应方程式表示:___________________________。
(2)25 ℃时,pH为9的CH3COONa溶液中c(OH-)=________。
(3)25 ℃时,将a mol·L-1氨水与0.01 mol·L-1盐酸等体积混合,反应平衡时溶液中c(NH![]() )=c(Cl-),则溶液显________(填“酸”“碱”或“中”)性。用含a的代数式表示NH3·H2O的电离常数Kb=___________。
)=c(Cl-),则溶液显________(填“酸”“碱”或“中”)性。用含a的代数式表示NH3·H2O的电离常数Kb=___________。
【答案】![]() +H2O
+H2O![]()
![]() +OHˉ Cu2++2H2O
+OHˉ Cu2++2H2O![]() 2H++Cu(OH)2 10-5mol/L 中
2H++Cu(OH)2 10-5mol/L 中 ![]()
【解析】
(1)碳酸钠溶液中因存在碳酸根的水解而显碱性,离子方程式为![]() +H2O
+H2O![]()
![]() +OHˉ;硫酸铜溶液中因存在铜离子的水解而显酸性,离子方程式为Cu2++2H2O
+OHˉ;硫酸铜溶液中因存在铜离子的水解而显酸性,离子方程式为Cu2++2H2O![]() 2H++Cu(OH)2;
2H++Cu(OH)2;
(2)25 ℃时,pH为9的CH3COONa溶液中c(H+)=10-9mol/L,溶液中c(OH-)=![]() =10-5mol/L;
=10-5mol/L;
(3)混合溶液中存在电荷守恒c(NH![]() )+c(H+)=c(OH-)+c(Cl-),因为c(NH
)+c(H+)=c(OH-)+c(Cl-),因为c(NH![]() )=c(Cl-),所以c(H+)=c(OH-),溶液显中性;NH3·H2O的电离常数Kb=
)=c(Cl-),所以c(H+)=c(OH-),溶液显中性;NH3·H2O的电离常数Kb=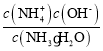 ,溶液显中性,所以c(OH-)=10-7mol/L,c(NH
,溶液显中性,所以c(OH-)=10-7mol/L,c(NH![]() )=c(Cl-),两溶液等体积混合后,氯离子的浓度变为原来的一半为5×10-3mol/L,所以c(NH
)=c(Cl-),两溶液等体积混合后,氯离子的浓度变为原来的一半为5×10-3mol/L,所以c(NH![]() )=5×10-3mol/L,根据物料守恒可知c(NH
)=5×10-3mol/L,根据物料守恒可知c(NH![]() )+ c(NH3·H2O)=0.5amol/L,则c(NH3·H2O)=(0.5a-5×10-3)mol/L,所以Kb=
)+ c(NH3·H2O)=0.5amol/L,则c(NH3·H2O)=(0.5a-5×10-3)mol/L,所以Kb=![]() 。
。


科目:高中化学 来源: 题型:
【题目】有ABC三种物质的无色溶液,它们分别为葡萄糖溶液、蔗糖溶液、淀粉溶液中的一种,经实验可知:
①B能发生银镜反应;②A遇碘水变蓝色;③AC均能发生水解反应,水解产物中均有能发生银镜反应的物质。
(1)写出下列各物质的名称:
A是________,B是________,C是________。
(2)分别写出A、C发生水解反应的化学方程式。
A:________________。C:________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钒(V)及其化合物广泛应用于工业催化、新材料和新能源等领域。
(1)V2O5是接触法制硫酸的催化剂。
①已知25℃,10lkPa时:
2SO2(g)+O2(g)+2H2O(1)=2H2SO4(1) △H = -457kJ·mol-l
SO3(g)+H2O(1)=H2SO4(1) △H= -130kJ·mol-l
则反应2SO2(g)+O2(g)![]() 2SO3(g)的△H=_______kJ·mol-l。使用V2O5作催化剂后该反应逆反应的活化能______(填“增大”、“不变”或“减小”)。
2SO3(g)的△H=_______kJ·mol-l。使用V2O5作催化剂后该反应逆反应的活化能______(填“增大”、“不变”或“减小”)。
②SO2水溶液可与SeO2反应得到硫酸,当有79gSe生成时,转移电子的物质的量为______mol,此反应的化学方程式是___________________________。
(2)全钒液流电池的结构如图所示,其电解液中含有钒的不同价态的离子、H+和SO42-。电池放电时,负极的电极反应为:V2+-e一=V3+。
①电池放电时的总反应方程式为____________。充电时,电极M应接电源的____________极。
②若电池初始时左、右两槽内均以VOSO4和H2SO4的混合液为电解液,使用前需先充电激活,充电过程阴极区的反应分两步完成:第一步VO2+转化为V3+;第二步V3+转化为V2+。则第一步反应过程中阴极区溶液n(H+)______(填“增大”、“不变”或“减小”),阳极的电极反应式为:_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】次氯酸溶液是常用的消毒剂和漂白剂。某学习小组根据需要欲制备浓度不小于0.8mol/L的次氯酸溶液。
资料1:常温常压下,Cl2O为棕黄色气体,沸点为3.8℃,42 ℃以上会分解生成Cl2和O2,Cl2O易溶于水并与水立即反应生成 HClO。
资料2:将氯气和空气(不参与反应)按体积比1∶3混合通入潮湿的碳酸钠中发生反应2Cl2+2Na2CO3+H2O=Cl2O+2NaCl+2NaHCO3,用水吸收Cl2O(不含Cl2)制得次氯酸溶液。
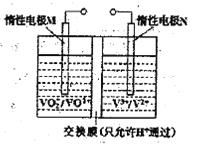
(装置及实验)用以下装置制备次氯酸溶液。
回答下列问题:
(1)各装置的连接顺序为_____→_____→_____→____→E。
(2)装置A中反应的离子方程式是__________________________。
(3)实验中控制氯气与空气体积比的方法是_____________________。
(4)反应过程中,装置B需放在冷水中,其目的是_________________________。
(5)装置E采用棕色圆底烧瓶是因为______________________。
(6)若装置B中生成的Cl2O气体有20%滞留在E前各装置中,其余均溶于装置E的水中,装置E所得500mL次氯酸溶液浓度为0.8mol/L,则至少需要含水8%的碳酸钠的质量为_________g。
(7)已知次氯酸可被H2O2、FeCl2等物质还原成Cl-。测定E中次氯酸溶液的物质的量浓度的实验方案为:用________________准确量取20.00 mL次氯酸溶液,加入足量的________溶液,再加入足量的________溶液,过滤,洗涤,真空干燥,称量沉淀的质量。(可选用的试剂:H2O2溶液、FeCl2溶液、AgNO3溶液。)
查看答案和解析>>
科目:高中化学 来源: 题型:
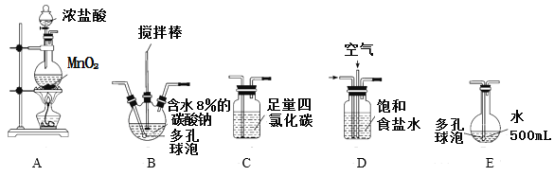
【题目】粗铜精炼后的阳极泥中含有Cu、Au(金)和PbSO4等杂质,湿法处理阳极泥进行综合利用的工艺流程如图所示:
(1)电解精炼含铜、金、铅的粗铜时,电解液应该用________溶液作电解液,电解时阳极的电极反应式为___________________________和Cu-2e-=Cu2+。
(2)完成操作Ⅰ的主要步骤有:__________________,过滤,洗涤,干燥。
(3)写出用SO2还原AuCl4-的离子反应方程式____________________________。
(4)为了减少废液排放、充分利用有用资源,工业上将滤液1并入硫酸铜溶液进行循环操作,请指出流程图中另一处类似的做法________________________。
(5)用离子方程式表示加入碳酸钠溶液的作用:___________________________。[已知298K时,Ksp(PbCO3)=1.46×10-13,Ksp(PbSO4)=1.82×10-8]。当溶液中c(SO42-)=0.2mol/L时,c(CO32-)=________mol/L。![]() 结果保留2位有效数字
结果保留2位有效数字![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于一些重要的化学概念有下列说法,其中正确的是( )
①Fe(OH)3胶体和CuSO4溶液都是混合物 ②BaSO4是一种难溶于水的强电解质 ③冰醋酸、纯碱、小苏打分别属于酸、碱、盐 ④煤的干馏、煤的气化和液化都属于化学变化 ⑤置换反应都属于离子反应
A.①②⑤B.①②④C.②③④D.③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电致变色玻璃以其优异的性能将成为市场的新宠。如图所示为五层膜的玻璃电致变色系统,其工作原理是:在外接电源下,通过在膜材料内部发生氧化还原反应,实现对器件的光透过率进行多级可逆性调节。(已知:WO3和Li4Fe4[Fe(CN)6]3均为无色透明,LiWO3和Fe4[Fe(CN)6]3均为蓝色)下列有关说法正确的是

A. 当B外接电源负极时,膜由无色变为蓝色
B. 当B外接电源负极时,离子储存层发生反应为:Fe4[Fe(CN)6]3+4Li++4eˉ=Li4Fe4[Fe(CN)6]3
C. 当A接电源的负极时,此时Li+得到电子被还原
D. 当A接电源正极时,膜的透射率降低,可以有效阻挡阳光
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NiSO4·xH2O是一种绿色易溶于水的晶体,广泛用于镀镍、电池等,可由电镀废渣(除镍外,还含有铜、锌、铁等元素)为原料获得。操作步骤如下:
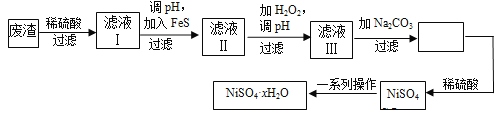
(1)在待镀件上镀镍时,待镀件应作_____极,电镀过程中电解质溶液浓度 _____(填“增大”、“减小”、“不变”)
(2)向滤液Ⅰ中加入FeS是为了除去Cu2+、Zn2+等杂质,则除去Cu2+的离子方程式为_____________。当Zn2+恰好沉淀完全时,在CuS、ZnS共存的混合液中c(Zn2+)=10-5mol/L ,则c(Cu2+)=_____mol/L (已知Ksp(CuS)=1.3×10-36,Ksp(ZnS)=1.6×10-24)。
(3)对滤液Ⅱ中先加H2O2再调pH,调pH的目的是__________________________。
(4)滤液Ⅲ溶质的主要成分是NiSO4,加入Na2CO3过滤后再加适量稀硫酸溶解又生成NiSO4,这两步操作的目的是______________________________。
(5)为测定NiSO4·xH2O晶体x的值,称取26.3 g晶体加热至充全失去结晶水,剩余固体15.5 g,则x的值等于___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高分子材料在疫情防控和治疗中起到了重要的作用。下列说法正确的是
A.聚乙烯是生产隔离衣的主要材料,能使酸性高锰酸钾溶液褪色
B.聚丙烯酸树脂是3D打印护目镜镜框材料的成分之一,可以与NaOH溶液反应
C.天然橡胶是制作医用无菌橡胶手套的原料,它是异戊二烯发生缩聚反应的产物
D.聚乙二醇可用于制备治疗新冠病毒的药物,聚乙二醇的结构简式为![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com