
| 酒化酶 |
| O2,催化剂 |
| △ |
| O2,催化剂 |
| △ |
科目:高中化学 来源: 题型:
| A、SO2通入到滴加酚酞的NaOH溶液中,红色变浅:SO2+2NaOH=Na2SO3+H2O |
| B、用Na2S处理含Hg2+废水:Hg2++S2-═HgS↓ |
| C、等浓度的NH4Al(SO4)2溶液与Ba(OH)2溶液以1:2体积比混合出现白色沉淀:NH4++Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+Al(OH)3↓+NH3?H2O |
| D、用Na2CO3溶液处理水垢中的CaSO4:Ca2++CO32-═CaCO3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
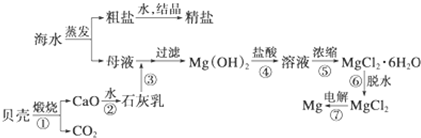
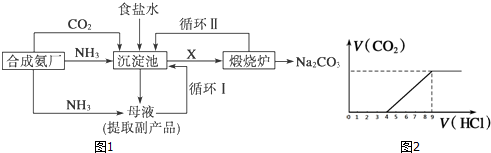
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验步骤 | 有关问题 |
| (1)计算所需KCl的质量 | 需要KCl的质量为 |
| (2)称量KCl固体 | 称量过程中主要用到的仪器是 |
| (3)将KCl加入100mL烧杯中,加适量蒸馏水溶解 | 为加快溶解,可采取的措施是 |
| (4)将烧杯中的溶液转移至500mL容量瓶中 | 为防止溶液溅出,应该采取的措施是 |
| (5)向容量瓶中加蒸馏水至刻度线 | 在进行此操作时应注意的问题是 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| t/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
| A、反应在前50 s的平均速率v(PCl3)=0.0032mol?L-1?s-1 |
| B、保持其他条件不变,升高温度,平衡时c(PCl3)=0.11mol?L-1,则反应的△H<0 |
| C、相同温度下,起始时向容器中充入1.0mol PCl5、0.20mol PCl3和0.20mol Cl2,反应达到平衡前v(正)>v(逆) |
| D、相同温度下,起始时向容器中充入2.0mol PCl3和2.0mol Cl2,达到平衡时,PCl3的转化率小于80% |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.3 mol NO2、0.1 mol NO |
| B、0.3 mol NO、0.1 mol NO2 |
| C、0.6 mol NO |
| D、0.3 mol NO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com