
【题目】Ⅰ.化合物Mg5Al3(OH)19(H2O)4可作环保型阻燃材料,受热时按如下化学方程式分解:
2Mg5Al3(OH)19(H2O)4![]() 27H2O↑+10MgO+3Al2O3
27H2O↑+10MgO+3Al2O3
(1)写出该化合物作阻燃剂的两条依据____________。
(2)用离子方程式表示除去固体产物中Al2O3的原理________。
(3)已知MgO可溶于NH4Cl的水溶液,用化学方程式表示其原理____________。
Ⅱ.磁性材料A是由两种元素组成的化合物,某研究小组按如图流程探究其组成:
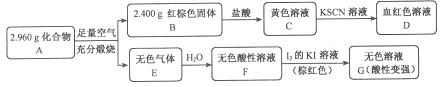
请回答:
(1)A的组成元素为_________(用元素符号表示),化学式为______。
(2)溶液C可溶解铜片,例举该反应的一个实际应用____________。
(3)已知化合物A能与稀硫酸反应,生成一种淡黄色不溶物和一种气体(标况下的密度为1.518 g·L-1),该气体分子的电子式为____。写出该反应的离子方程式__________。
(4)写出F→G反应的化学方程式_____________。设计实验方案探究溶液G中的主要微粒(不考虑H2O、H+、K+、I-)______________。
【答案】Ⅰ.(1)反应吸热降低温度,固体氧化物隔绝空气,水蒸气稀释空气
(2)Al2O3 +2OH![]() 2AlO2+H2O
2AlO2+H2O
(3)MgO+2NH4Cl+H2O![]() MgCl2+2NH3·H2O或NH4Cl+H2O
MgCl2+2NH3·H2O或NH4Cl+H2O![]() NH3·H2O+HCl,
NH3·H2O+HCl,
MgO+2HCl ![]() MgCl2+H2O
MgCl2+H2O
Ⅱ.(1)S、Fe Fe3S4
(2)制印刷电路板
(3)![]() Fe3S4+6H+
Fe3S4+6H+![]() 3H2S↑+3Fe2++S
3H2S↑+3Fe2++S
(4)H2SO3+I2+H2O![]() H2SO4+2HI
H2SO4+2HI
取溶液G,加入过量BaCl2溶液,若产生白色沉淀,则有SO42;过滤后取滤液,滴加H2O2溶液,若再产生白色沉淀,则有H2SO3。
【解析】
试题分析:Ⅰ.(1)此反应为吸热反应,能降低温度,反应产生的固体氧化物能隔绝空气,并且产生水蒸气,可以稀释空气。故答案为:反应吸热降低温度,固体氧化物隔绝空气,水蒸气稀释空气。
(2)氧化镁和氧化铝的区别在于氧化铝能与强碱反应而氧化镁不能,氧化铝和强碱反应生成偏铝酸盐和水,离子方程式为:Al2O3 +2OH![]() 2AlO2+H2O。(3)氯化铵溶液中铵根离子水解, NH4Cl+H2O
2AlO2+H2O。(3)氯化铵溶液中铵根离子水解, NH4Cl+H2O![]() NH3·H2O+HCl,溶液为酸性,氧化镁和水解生成的盐酸反应生成氯化镁,方程式为: MgO+2HCl
NH3·H2O+HCl,溶液为酸性,氧化镁和水解生成的盐酸反应生成氯化镁,方程式为: MgO+2HCl ![]() MgCl2+H2O。Ⅱ.(1)红棕色固体B为氧化铁,与盐酸反应后生成黄色溶液C为氯化铁,氯化铁与硫氰化钾溶液反应显血红色,D为硫氰化铁。无色气体溶于水后为酸性,与碘反应后生成无色溶液,酸性变强,说明原酸为弱酸,且具有还原性,为亚硫酸,则无色气体为二氧化硫。则原化合物中含有铁和硫元素。氧化铁的质量为2.400g,其物质的量为2.400/160=0.015mol,含铁原子的物质的量为0.030mol,则铁的质量为0.030×56=1.680g,则化合物中硫元素的质量为2.960-1.680=1.280g,硫的物质的量为1.280/32=0.040mol,则铁与硫的物质的量比为0.030:0.040=3:4,则化学式为:Fe3S4。(2)溶液C为氯化铁,可以溶解铜,用来制印刷电路板。(3)化合物A与硫酸反应生成淡黄色不溶物为硫,和一种气体,该气体的摩尔质量为1.518×22.4=34.00,则为硫化氢。硫化氢的电子式为
MgCl2+H2O。Ⅱ.(1)红棕色固体B为氧化铁,与盐酸反应后生成黄色溶液C为氯化铁,氯化铁与硫氰化钾溶液反应显血红色,D为硫氰化铁。无色气体溶于水后为酸性,与碘反应后生成无色溶液,酸性变强,说明原酸为弱酸,且具有还原性,为亚硫酸,则无色气体为二氧化硫。则原化合物中含有铁和硫元素。氧化铁的质量为2.400g,其物质的量为2.400/160=0.015mol,含铁原子的物质的量为0.030mol,则铁的质量为0.030×56=1.680g,则化合物中硫元素的质量为2.960-1.680=1.280g,硫的物质的量为1.280/32=0.040mol,则铁与硫的物质的量比为0.030:0.040=3:4,则化学式为:Fe3S4。(2)溶液C为氯化铁,可以溶解铜,用来制印刷电路板。(3)化合物A与硫酸反应生成淡黄色不溶物为硫,和一种气体,该气体的摩尔质量为1.518×22.4=34.00,则为硫化氢。硫化氢的电子式为![]() ,该反应生成硫酸亚铁和硫和硫化氢,方程式为:Fe3S4+6H+
,该反应生成硫酸亚铁和硫和硫化氢,方程式为:Fe3S4+6H+![]() 3H2S↑+3Fe2++S。(4)亚硫酸和碘单质反应生成硫酸和氢碘酸,方程式为:H2SO3+I2+H2O
3H2S↑+3Fe2++S。(4)亚硫酸和碘单质反应生成硫酸和氢碘酸,方程式为:H2SO3+I2+H2O![]() H2SO4+2HI;溶液G中主要含有硫酸根离子,或许有未反应完的亚硫酸分子,硫酸根离子用钡盐检验,亚硫酸可以用氧化剂氧化成硫酸根再检验,具体操作方法为:取溶液G,加入过量BaCl2溶液,若产生白色沉淀,则有SO42,过滤后取滤液,滴加H2O2溶液,若产生白色沉淀,则有H2SO3。
H2SO4+2HI;溶液G中主要含有硫酸根离子,或许有未反应完的亚硫酸分子,硫酸根离子用钡盐检验,亚硫酸可以用氧化剂氧化成硫酸根再检验,具体操作方法为:取溶液G,加入过量BaCl2溶液,若产生白色沉淀,则有SO42,过滤后取滤液,滴加H2O2溶液,若产生白色沉淀,则有H2SO3。


 新课标同步训练系列答案
新课标同步训练系列答案科目:高中化学 来源: 题型:
【题目】已知Q、R、X、Y、Z、W都是周期表中前四周期的元素,它们的核电荷数依次增大,其中Q原子外层电子数是内层电子数的两倍;化合物R2Z的晶体为离子晶体,Z原子核外的M层中有两对成对电子;X元素最外层电子数与最内层电子数相同;Y单质的晶体类型在同周期的单质中没有相同的;W元素所在族有三列,只有两个未成对的电子。请根据以上信息,回答下列问题:(答题时,Q、R、X、Y、Z、W用所对应的元素符号表示)
(1)W的外围电子(价电子)排布式是 。
(2)Q、R、X、Y的第一电离能由小到大的顺序为_ 。(用元素符号表示)
(3)QZ2分子的空间构型为 形。
(4)R的氯化物的熔点比Y的氯化物的熔点_ _(填高或低),理由是_ _ 。
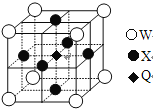
(5)据报道,只含Q、X、W三种元素的晶体竟然具有超导性。鉴于这三种元素都是常见元素,从而引起广泛关注。该晶体的结构如图,试写出该晶体的化学式_ 。晶体中每个X原子周围距离最近的W原子有__ _个。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[物质结构与性质]
[Zn(CN)4]2–在水溶液中与HCHO发生如下反应:
4HCHO+[Zn(CN)4]2–+4H++4H2O===[Zn(H2O)4]2++4HOCH2CN
(1)Zn2+基态核外电子排布式为____________________。
(2)1 mol HCHO分子中含有σ键的数目为____________mol。
(3)HOCH2CN分子中碳原子轨道的杂化类型是______________。
(4)与H2O分子互为等电子体的阴离子为________________。
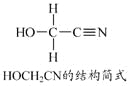
(5)[Zn(CN)4]2–中Zn2+与CN–的C原子形成配位键。不考虑空间构型,[Zn(CN)4]2–的结构可用示意图表示为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨催化氧化法制硝酸的原理为4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g)。在浓氨水中通入空气,将赤热铂丝插入氨水中引发反应后铂丝保持红热状态至反应停止。下列说法正确的是
4NO(g)+6H2O(g)。在浓氨水中通入空气,将赤热铂丝插入氨水中引发反应后铂丝保持红热状态至反应停止。下列说法正确的是
A. 上述反应在较高温度下才能自发进行
B. 该反应的正反应活化能小于逆反应活化能
C. 该反应中,断裂化学键的总键能大于形成化学键的总键能
D. 若NH3和O2的混合气发生上述反应,气体通入足量水中,剩余气体一定是O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在实验室中用二氧化锰跟浓盐酸反应制备干燥纯净的氯气。进行此实验,所用仪器如下图:
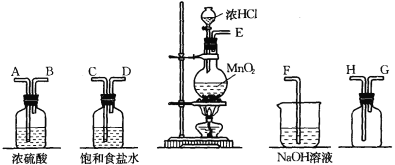
(1)连接上述仪器的正确顺序是(填各接口处的字母):
接 ,____ 接 ,___ 接 , 接 。
(2)化学实验中检验是否有Cl2产生常用湿润的淀粉-KI试纸。如果有Cl2产生,可观察到的现象是 。写出该反应的化学反应方程式 。
(3)写出下列化学反应的离子方程式:
①气体发生装置中进行的反应:_________________________;
②尾气吸收装置中进行的反应: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等电子体之间结构相似、物理性质也相近.根据等电子原理,由短周期元素组成的粒子,只要其原子总数和原子最外层电子总数相同,均可互称为等电子体.下列各组粒子不能互称为等电子体的是( )
A. CO32-和NO3- B. O3和SO2
C. CO2和NO2- D. SCN-和N3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国《可再生能源法》倡导碳资源的高效转化及循环利用。下列做法与上述理念相违背的是
A.大力发展煤的气化及液化技术
B.加快石油等化石燃料的开采和使用
C.以CO2为原料生产可降解塑料
D.将秸秆进行加工转化为乙醇燃料
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com