
| A. | △H4=$\frac{3}{2}$(△H1+△H2+3△H3) | B. | △H4=$\frac{2}{3}$(3△H3-△H1-△H2) | ||
| C. | △H4=$\frac{2}{3}$ (△H1+△H2-3△H3) | D. | △H4=$\frac{3}{2}$(△H1-△H2-3△H3) |
分析 由①H2S(g)+$\frac{3}{2}$O2(g)=SO2(g)+H2O(g)△H1
②2H2S(g)+SO2(g)=S2(g)+2H2O (g)△H2
③H2S(g)+O2(g)=S(g)+H2O(g)△H3
结合盖斯定律可知,(①+②-③×3)×$\frac{2}{3}$得到2S(g)=S2,以此来解答.
解答 解:由①H2S(g)+$\frac{3}{2}$O2(g)=SO2(g)+H2O(g)△H1
②2H2S(g)+SO2(g)=S2(g)+2H2O (g)△H2
③H2S(g)+O2(g)=S(g)+H2O(g)△H3
结合盖斯定律可知,(①+②-③×3)×$\frac{2}{3}$得到2S(g)=S2,
则2S(g)=S2(g)△H4=$\frac{2}{3}$ (△H1+△H2-3△H3),
故选C.
点评 本题考查反应热与焓变,为高频考点,把握反应的关系、盖斯定律的应用为解答的关键,侧重分析与应用能力的考查,注意已知反应与目标反应的关系,题目难度不大.


科目:高中化学 来源: 题型:实验题
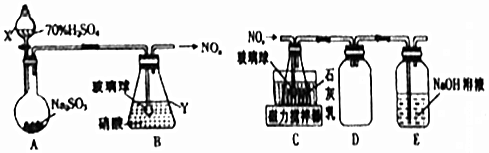
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 离子 | 开始沉淀pH | 沉淀完全pH |
| Fe2+ | 7.6 | 9.6 |
| Fe3+ | 2.7 | 3.7 |
| Zn2+ | 5.4 | 8.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硫酸在常温下可迅速与铜片反应放出二氧化硫气体 | |
| B. | 在含有Cu(NO3)2、Mg(NO3)2和AgNO3的溶液中加入适量锌粉,首先置换出的是Cu | |
| C. | 能与酸反应生成盐和水的氧化物一定是碱性氧化物 | |
| D. | 将Ba(OH)2溶液滴到明矾溶液中,当SO42-刚沉淀完时,铝以AlO2-的形式存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化铁溶于氢碘酸溶液中:Fe(OH)3+3HI═Fe3++3I-+3H2O | |
| B. | 少量CO2通入苯酚钠溶液中: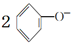 +H2O+CO2→ +H2O+CO2→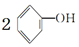 +CO32- +CO32- | |
| C. | 向NaAlO2溶液中通入足量CO2:2AlO2-+3H2O+CO2═2Al(OH)3↓+CO32- | |
| D. | Ca(HCO3)2溶液与足量NaOH溶液反应:Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
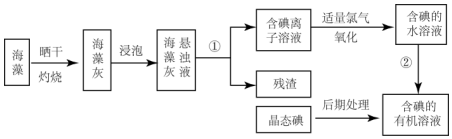
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com