
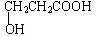 £»Čō¼×ÄÜ·¢ÉśŅų¾µ·“Ó¦£¬Ōņ¼×µÄ½į¹¹¼ņŹ½ĪŖ
£»Čō¼×ÄÜ·¢ÉśŅų¾µ·“Ó¦£¬Ōņ¼×µÄ½į¹¹¼ņŹ½ĪŖ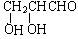 £®
£®
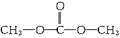 £®
£® ·ÖĪö £Ø1£©ŅņĪŖ1 mol¼×£ØC3H6O3£©Óė×ćĮæÄĘ·“Ӧɜ³É1 mol H2£¬Ōņ¼×·Ö×ÓÖŠŗ¬ÓŠĮ½øö-OH»ņŅ»øö-OHŗĶŅ»øö-COOH£¬Čō¼×ÓėNaHCO3ČÜŅŗ·“Ó¦£¬ĒŅ·Ö×ÓÖŠĪŽ¼×»ł£»ČōÄÜ·¢ÉśŅų¾µ·“Ó¦£¬Ōņŗ¬ÓŠČ©»ł£»
£Ø2£©Ķ¬ĄąŌ×ӵĻÆѧ»·¾³ĻąĶ¬£¬¼“ŅŅ·Ö×ÓÖŠµÄ3øöĢ¼Ō×Ó»ņ3øöŃõŌ×ÓĖł“¦µÄĪ»ÖĆĻąĶ¬£¬²»Óė½šŹōNa·“Ó¦ĖµĆ÷²»ŗ¬ōĒ»ł£»
£Ø3£©±ūÓė½šŹōNa²»·“Ó¦£¬±ūÖŠ²»ŗ¬ōĒ»ł£¬ĒāµÄ»Æѧ»·¾³ĻąĶ¬£¬ĖµĆ÷ĒāŌ×Ó¶¼ŹĒµČŠ§µÄ£»ŅņĪŖĢ¼”¢Ńõø÷ÓŠĮ½ÖÖ²»Ķ¬µÄ»Æѧ»·¾³£¬ĖµĆ÷±ū·Ö×ÓÖŠµÄĢ¼Ō×Ó”¢ŃõŌ×ÓÓŠĮ½ÖÖ²»Ķ¬Ī»ÖĆ£®
½ā“š ½ā£ŗ£Ø1£©ŅņĪŖ1 mol¼×£ØC3H6O3£©Óė×ćĮæÄĘ·“Ӧɜ³É1 mol H2£¬Ōņ¼×·Ö×ÓÖŠŗ¬ÓŠĮ½øö-OH»ņŅ»øö-OHŗĶŅ»øö-COOH£®Čō¼×ÓėNaHCO3ČÜŅŗ·“Ó¦£¬ĒŅ·Ö×ÓÖŠĪŽ¼×»ł£¬¹Ź¼×µÄ½į¹¹¼ņŹ½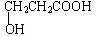 £»Čō¼×ÄÜ·¢ÉśŅų¾µ·“Ó¦£¬ĖµĆ÷ŗ¬ÓŠ2øöōĒ»łŗĶŅ»øöČ©»ł£¬¼×µÄ½į¹¹¼ņŹ½ĪŖ
£»Čō¼×ÄÜ·¢ÉśŅų¾µ·“Ó¦£¬ĖµĆ÷ŗ¬ÓŠ2øöōĒ»łŗĶŅ»øöČ©»ł£¬¼×µÄ½į¹¹¼ņŹ½ĪŖ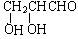 £¬
£¬
¹Ź“š°øĪŖ£ŗ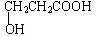 £»
£»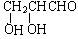 £»
£»
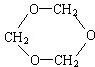
£Ø2£©ŅņĪŖĶ¬ĄąŌ×ӵĻÆѧ»·¾³ĻąĶ¬£¬¼“ŅŅ·Ö×ÓÖŠµÄ3øöĢ¼Ō×Ó»ņ3øöŃõŌ×ÓĖł“¦µÄĪ»ÖĆĻąĶ¬£¬ĒŅ²»ŗ¬ÓŠ-OH£¬ĖłŅŌŅŅµÄ½į¹¹¼ņŹ½ĪŖ £¬
£¬
¹Ź“š°øĪŖ£ŗ £»
£»
£Ø3£©±ūÖŠ²»ŗ¬ōĒ»ł£¬ĒāµÄ»Æѧ»·¾³ĻąĶ¬£¬ĖµĆ÷ĒāŌ×Ó¶¼ŹĒµČŠ§µÄ£»ŅņĪŖĢ¼”¢Ńõø÷ÓŠĮ½ÖÖ²»Ķ¬µÄ»Æѧ»·¾³£¬ĖµĆ÷±ū·Ö×ÓÖŠµÄĢ¼Ō×Ó”¢ŃõŌ×ÓÓŠĮ½ÖÖ²»Ķ¬Ī»ÖĆ£¬Ęä½į¹¹¼ņŹ½ĪŖ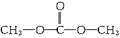 £¬¹Ź“š°øĪŖ£ŗ
£¬¹Ź“š°øĪŖ£ŗ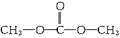 £®
£®
µćĘĄ ±¾Ģāæ¼²éĮĖÓŠ»śĪļµÄĶʶĻ£¬²ąÖŲæ¼²éÓŠ»śĪļ½į¹¹ÓėŠŌÖŹ£¬ĢāÄæÄѶČÖŠµČ£¬Ć÷Č·³£¼ūÓŠ»śĪļ½į¹¹ÓėŠŌÖŹĪŖ½ā“š¹Ų¼ü£¬×¢ŅāÕĘĪÕĶ¬·ÖŅģ¹¹ĢåµÄøÅÄī¼°ŹéŠ“ŌŌņ£¬ŹŌĢāÅąŃųĮĖѧɜĮé»īÓ¦ÓĆ»ł“”ÖŖŹ¶µÄÄÜĮ¦£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŹµŃéĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | BCl3 | B£® | NCl3 | C£® | H2S | D£® | BeCl2 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
| ŃōĄė×Ó | K+”¢Na+”¢NH4+”¢Fe2+”¢Ba2+”¢Cu2+ |
| ŅõĄė×Ó | OH-”¢I-”¢NO3-”¢AlO2-”¢HCO3-”¢HSO4- |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | H2SO4£Øaq£©+2NaOH£Øaq£©ØTNa2SO4£Øaq£©+2H2O£Øl£© | |
| B£® | $\frac{1}{2}$H2SO4£Øaq£©+$\frac{1}{2}$Ba£ØOH£©2£Øaq£©ØTBaSO4£Øs£©+H2O£Øl£© | |
| C£® | HCl£Øaq£©+NaOH£Øaq£©ØTNaCl£Øaq£©+H2O£Øl£© | |
| D£® | HCl£Øaq£©+NH3•H2O£Øaq£©ØTNH4Cl£Øaq£©+H2O£Øl£© |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā

²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
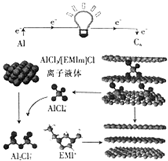 Ó¢¹ś”¶×ŌČ»”·ŌÓÖ¾½üĘŚ±ØµĄĮĖŅ»ÖÖÓĆÅŻÄŹÆÄ«Ļ©£ØCn£©×÷Õż¼«²ÄĮĻµÄŠĀŠĶĀĮĄė×Óµē³Ų£¬Ęä·ÅµēŹ±µÄ¹¤×÷ŌĄķČēĶ¼ĖłŹ¾£®ĻĀĮŠĖµ·Ø²»ÕżČ·µÄŹĒ£Ø””””£©
Ó¢¹ś”¶×ŌČ»”·ŌÓÖ¾½üĘŚ±ØµĄĮĖŅ»ÖÖÓĆÅŻÄŹÆÄ«Ļ©£ØCn£©×÷Õż¼«²ÄĮĻµÄŠĀŠĶĀĮĄė×Óµē³Ų£¬Ęä·ÅµēŹ±µÄ¹¤×÷ŌĄķČēĶ¼ĖłŹ¾£®ĻĀĮŠĖµ·Ø²»ÕżČ·µÄŹĒ£Ø””””£©| A£® | ·ÅµēŹ±£¬ČōĶāµēĀ·ÖŠ×ŖŅĘ1molµē×Ó£¬Ōņøŗ¼«ÖŹĮæ¼õÉŁ9g | |
| B£® | ³äµēŹ±£¬ŹÆÄ«Ļ©×÷Ńō¼« | |
| C£® | ³äµēŹ±£¬Ņõ¼«µÄµē¼«·“Ó¦Ź½ĪŖAlCl4-+3e-ØTAl+4Cl- | |
| D£® | ·ÅµēŹ±£¬Õż¼«µÄµē¼«·“Ó¦Ź½ĪŖCn£ØAlCl4-£©+e-ØTCn+AlCl4- |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com