
| 实验编号 | HA物质的量浓度(mol/L) | NaOH物质的量浓度(mol/L) | 混合溶液的pH |
| ① | 0.1 | 0.1 | pH=9 |
| ② | c | 0.2 | pH=7 |
| ③ | 0.2 | 0.1 | pH<7 |
分析 I.任何电解质溶液中都存在电荷守恒,根据电荷守恒计算氢离子浓度,从而计算溶液pH;
II.相同浓度的钠盐溶液,酸越弱其钠盐pH越大,所以酸性HB>HD;
NaA溶液呈中性,则NaA是强酸强碱盐,则HA是强酸;
1mol/L的KC溶液遇酚酞试液呈红色,则KC是强碱弱酸盐,则HC是弱酸;同体积、同物质的量浓度的HB、HC分别作导电性试验,发现后者的导电性比前者强,则酸性HC>HB,据此判断酸性强弱;
III.(1)根据①知,等物质的量的HA和NaOH恰好反应生成NaA,溶液呈碱性,则NaA是强碱弱酸盐;
(2)①中由水电离出的c(OH-)=$\frac{{K}_{w}}{c({H}^{+})}$=$\frac{{K}_{w}}{1{0}^{-pH}}$;
(3)NaA是强碱弱酸盐,其溶液呈碱性,要使混合溶液呈中性,则酸应该稍微过量;溶液呈中性,则c(OH-)=c(H+),根据电荷守恒判断c(A-)与c(Na+)相对大小;
(4)物质的量浓度相等的HA、NaA混合溶液pH<7,说明HA的电离程度大于A-水解程度,但水解程度较小,根据电荷守恒判断c(A-)与c(Na+)相对大小.
解答 解:I.任何电解质溶液中都存在电荷守恒,根据电荷守恒得c(H+)=2c(SO42-)+c(Cl-)+c(NO3-)-c(Na+)-2c(Ca2+)=2×2.5×10-4 mol/L+1.6×10-5 mol/L+1.4×10-5 mol/L-4×10-4mol/L-2×1.5×10-5 mol/L=10-4 mol/L,则溶液的pH=4,故答案为:4;
II.相同浓度的钠盐溶液,酸越弱其钠盐pH越大,所以酸性HB>HD;
NaA溶液呈中性,则NaA是强酸强碱盐,则HA是强酸;
1mol/L的KC溶液遇酚酞试液呈红色,则KC是强碱弱酸盐,则HC是弱酸;同体积、同物质的量浓度的HB、HC分别作导电性试验,发现后者的导电性比前者强,则酸性HC>HB,所以酸性强弱顺序是HA>HC>HB>HD,
故答案为:HA>HC>HB>HD;
III.(1)根据①知,等物质的量的HA和NaOH恰好反应生成NaA,溶液呈碱性,则NaA是强碱弱酸盐,所以HA是弱酸,故答案为:弱酸;
(2)①中由水电离出的c(OH-)=$\frac{{K}_{w}}{c({H}^{+})}$=$\frac{{K}_{w}}{1{0}^{-pH}}$=$\frac{1{0}^{-14}}{1{0}^{-9}}$mol/L=10-5mol/L,故答案为:10-5;
(3)NaA是强碱弱酸盐,其溶液呈碱性,要使混合溶液呈中性,则酸应该稍微过量,酸碱体积相等,则c>0.2mol/L;溶液呈中性,则c(OH-)=c(H+),根据电荷守恒得c(A-)=c(Na+),故答案为:大于;c(A-)=c(Na+);
(4)物质的量浓度相等的HA、NaA混合溶液pH<7,说明HA的电离程度大于A-水解程度,但水解程度较小,根据电荷守恒得c(A-)>c(Na+),所以离子浓度大小顺序是,故答案为:大于;c(A-)>c(Na+)>c(H+)>c(OH-).
点评 本题考查弱电解质的电离、酸碱混合溶液定性判断等知识点,侧重考查分析推断能力,明确溶液中的溶质及其性质是解本题关键,难点是计算溶液中水电离出的氢离子或氢氧根离子浓度.


科目:高中化学 来源: 题型:实验题
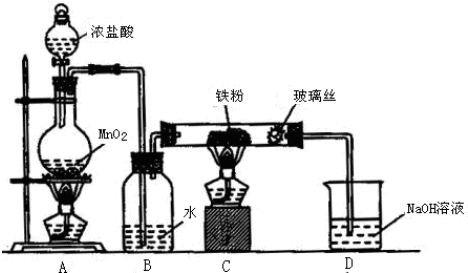
查看答案和解析>>
科目:高中化学 来源:2017届江苏省如皋市高三上学期质量调研一化学试卷(解析版) 题型:选择题
下列有关物质的性质与应用相对应的是
A.碳酸钠溶液呈碱性,可用于洗去铁屑表面的油污
B.铝易发生钝化,可用于作飞机、火箭的结构材料
C.炭具有还原性,可用于冶炼钠、镁、铝等金属
D.浓硫酸具有强氧化性,可用于干燥二氧化硫气体
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 .
.
| N(N2)/mol | N(H2)/mol | N(NH3)/mol | |
| 甲 | 1 | 3 | 0 |
| 乙 | 0.5 | 1.5 | 1 |
| 丙 | 0 | 0 | 4 |
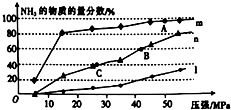
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素的非金属性顺序为R>Y>W | |
| B. | R与其他三种元素均能形成共价化合物 | |
| C. | 简单氢化物的热稳定性顺序为R>W>Y | |
| D. | 原子半径次序为W>R>X>Y |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
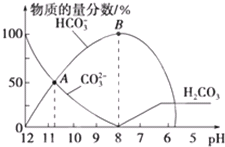
| A. | 当溶液的pH=7时,溶液的总体积为20mL(若忽略溶液混合后体积的变化) | |
| B. | 在0.1mol/L 的Na2CO3溶液中:c(Na+)+c(H+)═c(CO32-)+c(OH-)+c(HCO3-) | |
| C. | 在A点所示的溶液中:c(CO32-)═c(HCO3-)>c(H+)>c(OH-) | |
| D. | 在B点所示的溶液中,浓度最大的阳离子是Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
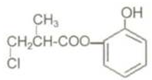
| A. | 有机物A与浓硫酸混合加热,可以发生消去反应 | |
| B. | 1molA和足量的H2发生加成反应,最多可以消耗4molH2 | |
| C. | 1molA和足量NaOH溶液发生反应,最多可以消耗 4molNaOH | |
| D. | 有机物A的同分异构体中能在稀硫酸下水解生成二苯酚的有6种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com