
分析 (1)利用盖斯定律分析,根据待求的热化学方程式调整已知的热化学方程式,让已知的热化学方程式进行加和得到待求的热化学方程式,焓变也进行相应的加和;
(2)①基本模式--“三段式”,已知Cl2的初始浓度且已知转化率,得Cl2的变化浓度,根据浓度变化之比等于化学计量系数之比,求出CO的变化浓度,可求出其速率.
已知初始浓度、变化浓度就可以求出平衡浓度,带入平衡常数表达式即可(注意固体和纯液体不列入平衡常数表达式);
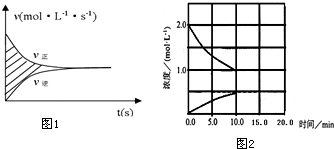
②阴影部分的面积为到达平衡时CO物质的量浓度的增加量为0.032mol/L;
③直接判断标志:等:ν正=ν逆,定:各组分的量均不再发生改变;
间接判断标志:密度、压强、平均摩尔质量----“变”量“不变”表征平衡;
④结合平衡常数计算;
(3)化学平衡常数的外界因素只与温度有关,故改变压强化学平衡常数不变;
若改变温度,根据同吸异放的规律,该反应为吸热反应,升高温度,平衡常数增大.
解答 解:(1)利用盖斯定律分析,根据待求的热化学方程式调整已知的热化学方程式,让已知的热化学方程式进行加和得到待求的热化学方程式,焓变也进行相应的加和,③+①×2-②,则△H=141+(-393.5)×2-(-566)=-80KJ/mol,
故答案为:-80KJ/mol;
(2)①TiO2(s)+2Cl2(g)+2C(s)?TiCl4(s)+2CO(g)
起始:0.04mol/L 0mol/L
转化:0.04mol/L×80%=0.032mol/L 0.032mol/l
平衡:0.008mol/L 0.032mol/L
v(CO)=$\frac{△C}{△T}$=$\frac{0.032mol/l}{5s}$=6.4×10-3mol/(L•s),
K=$\frac{[CO]2}{[Cl2]2}$=$\frac{(0.032mol/L)2}{(0.008mol/L)2}$=16,
故答案为:6.4×10-3;16;
②图中aodb和bod围成的面积大小在数值上分别等于正反应CO浓度的增加量和逆反应CO浓度的减少量,由此可见
阴影部分的面积为到达平衡时CO物质的量浓度的净增加量为0.032mol/L,
故答案为:0.032mol/L;
③A.据ρ=$\frac{m}{v}$,该反应反应前后不全部为气体,气体的总质量为变值,容器的体积V为定值,则ρ为变值,当变值不变了可以表征平衡了,A不选;
B.容器的压强与气体总的物质的量成正比,该反应前后气体的物质的量不变,容器的压强始终为定值,不能表征平衡,B选;
C.CO的浓度不变,说明体系中各组分的量均不再发生改变,说明达到平衡,C不选;
D.TiCl4虽然为固体,在一定的温度下,其物质的量浓度为定值,但是其物质的量是变,TiCl4物质的量不随时间变化,说明达到平衡,D不选;
E.若TiCl4与CO初始物质的量之比等于化学计量系数之比,不管平衡不平衡,TiCl4与CO物质的量之比始终不随时间变化,不能说明平衡,E选.
故答案为:BE;
④TiO2(s)+2Cl2(g)+2C(s)?TiCl4(s)+2CO(g)
起始:(0.04+0.008)mol/L 0.032mol/L
转化:x x
平衡:(0.048-x)mol/L ( 0.032+x)mol/L
温度不变的前提下,平衡常数K值不变,K=16=$\frac{(0.032+x)2}{(0.048-x)2}$,得x=0.016mol/L
重新达到平衡后Cl2的浓度为0.048-0.016=0.032mol/L,
故答案为:0.032mol/L;
(3)TiO2(s)+2Cl2(g)?TiCl4(s)+O2(g)
平衡:1.0mol/L 0.5mol/L
k=$\frac{0.5}{1}$=0.5,
若改变温度,根据同吸异放的规律,该反应为吸热反应,升高温度,平衡常数增大;
故答案为:0.5; 增大.
点评 该题目考查盖斯定律焓变的计算;考查化学平衡计算--“三段式”及相关的转化率的计算、化学平衡常数的计算;考查化学平衡状态的判断标志(特别是D选项易错点);考查化学平衡常数外界因素只与温度有关.该题目考察面广,热点、考点集中全面.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
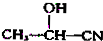 $→_{H_{2}O}^{HCl}$
$→_{H_{2}O}^{HCl}$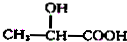
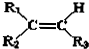 $→_{②Zn/H_{2}O}^{①O}$
$→_{②Zn/H_{2}O}^{①O}$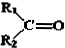 +
+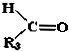
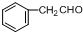 .现有如下转化关系:
.现有如下转化关系: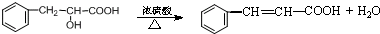 ;反应类型为消去反应;
;反应类型为消去反应;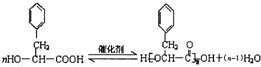 ;
;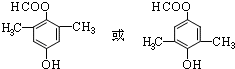 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
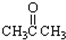 ③CH3CH2Br④
③CH3CH2Br④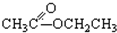 ⑤
⑤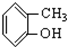 ⑥
⑥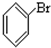 ⑦
⑦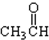 ⑧
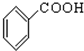
⑧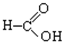 ⑨
⑨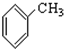 (10))
(10))
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 体积减半,则压强为原来的两倍 | |
| B. | 平衡向右移动,混合气体的颜色一定会变浅 | |
| C. | 体积减半,压强增大,但小于原来的2倍 | |
| D. | 体积减半,压强增大,且大于原来的2倍 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com