
分析 n(H+)=0.2L×2mol/L×2+0.2L×1mol/L=1mol/L,n(NO3-)=0.4mol,n(Cu)=$\frac{9.6g}{24g/mol}$=0.4mol,结合3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O计算.
解答 解:(1)Cu与混合酸发生氧化还原反应,离子反应为3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,故答案为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;
(2)若9.6g铜粉反应,由3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O可知,
0.4molCu完全反应消耗0.4mol×$\frac{8}{3}$>1mol,消耗硝酸根离子为0.4mol×$\frac{2}{3}$<0.4mol,
则氢离子不足,理论上最多可收集到标况下的气体体积为1mol×$\frac{2}{8}$×22.4L/mol=5.6L,
答:理论上最多可收集到标况下的气体体积为5.6L.
点评 本题考查氧化还原反应的计算,为高频考点,把握发生的离子反应及过量判断为解答的关键,侧重分析与计算能力的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 若容积为某一固定值,当体系的压强不再发生变化时说明达到化学平衡状态 | |
| B. | 若上述可逆反应达化学平衡状态后,给平衡体系加压(缩小容积,其他条件不变),则容器内气体的平均摩尔质量将减小 | |
| C. | 若上述可逆反应达到化学平衡状态后,升高温度(其他条件不变)体系颜色加深,则Q>0 | |
| D. | 对于上述可逆过程给平衡体系减压(增大容积,其他条件不变),可以提高N2O4的产率 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
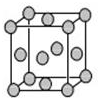 已知T、W、X、Y、Z是元素周期表前四周期中的常见元素,原子序数依次增大,相关信息如表.
已知T、W、X、Y、Z是元素周期表前四周期中的常见元素,原子序数依次增大,相关信息如表.| 元素 | 相关信息 |
| T | T元素可形成自然界硬度最大的单质 |
| W | W与T同周期,核外有一个未成对电子 |
| X | X原子的第一电离能至第四电离能分别是:I1=578kJ•mol-1,I2=1817kJ•mol-1, I3=2745kJ•mol-1,I4=11575kJ•mol-1 |
| Y | 常温常压下,Y单质是固体,其氧化物是形成酸雨的主要物质 |
| Z | Z的一种同位素的质量数为63,中子数为34 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
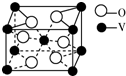 钒及其化合物非常丰富.钒可用于生产合金钢、航天用的钒钛合金及化工催化剂等.
钒及其化合物非常丰富.钒可用于生产合金钢、航天用的钒钛合金及化工催化剂等.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
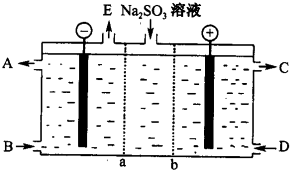
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 晶胞是晶体结构中的基本结构单元 | |
| B. | 根据晶体的不同,晶胞可以是多种形状的几何体 | |
| C. | 晶胞一般都是平行六面体 | |
| D. | 晶胞都是正八面体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
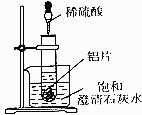 如图所示,把试管放人盛有25℃饱和澄清石灰水的烧杯中,开始往试管中加人若干铝片,再用滴管向试管中加人10mL1mol•L-1稀硫酸.
如图所示,把试管放人盛有25℃饱和澄清石灰水的烧杯中,开始往试管中加人若干铝片,再用滴管向试管中加人10mL1mol•L-1稀硫酸.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | M 中一定不含Mg(OH)2 | B. | M中一定含有MgCO3 | ||
| C. | 5.78 g M中含CaCO30.05mol | D. | 水垢中碳酸盐质量分数为0.823 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
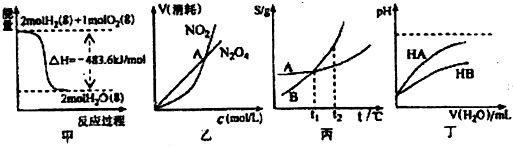
| A. | 甲表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为483.6kJ•mol-l | |
| B. | 乙表示恒温恒容条件下发生的可逆反应2NO2?N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态 | |
| C. | 丙表示A、B两物质的溶解度随温度变化情况,将A、B饱和溶液分别由t1℃升温至t2℃时,溶质的质量分数B=A | |
| D. | 丁表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则同浓度的NaA溶液的pH大于NaB溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com