
氧化锌为白色粉末,可用于湿疹、癣等皮肤病的治疗。纯化工业级氧化锌[含有Fe(Ⅱ)、Mn(Ⅱ)、Ni(Ⅱ)等杂质]的流程如下:
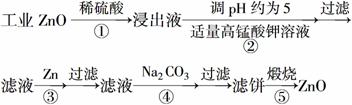
提示:在本实验条件下,Ni(Ⅱ)不能被氧化;高锰酸钾的还原产物是MnO2。
则:反应②中除掉的杂质离子是__________,发生反应的离子方程式为__________;在加高锰酸钾溶液前,若pH较低,对除杂的影响是________________。
科目:高中化学 来源: 题型:
按右图所示的装置进行电解实验,A极是铜锌合金,B极为纯铜,电解质中含有足量的铜离子。通电一段时间后,若A极恰好全部溶解,此时B极的质量增加7.68 g,溶液的质量增加0.03 g,则铜锌合金中Cu、Zn原子的个数比为
( )。

A.3∶1 B.4∶1 C.2∶1 D.任意比
查看答案和解析>>
科目:高中化学 来源: 题型:
汽车尾气(含烃类、CO、NO与SO2等)是城市主要污染源之一,治理的办法之一是在汽车排气管上装催化转化器,它使NO与CO反应生成可参与大气生态循环的无毒气体,反应原理:2NO(g)+2CO(g)===N2(g)+2CO2(g),在298 K、101 kPa下,ΔH=-113 kJ·mol-1、ΔS=-145 J·mol-1·K-1。下列说法中错误的是( )
A.该反应中反应物的总能量高于生成物的总能量
B.该反应常温下不能自发进行,因此需要高温和催化剂
C.该反应常温下能自发进行,高温和催化剂只是加快反应的速率
D.汽车尾气中的这两种气体会与血红蛋白结合而使人中毒
查看答案和解析>>
科目:高中化学 来源: 题型:
黄铜矿(CuFeS2)常用于提炼金属铜。黄铜矿焙烧过程中所发生的反应比较复杂,其中主要反应之一的化学方程式为2CuFeS2+O2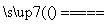
 +2FeS+SO2(已配平),则下列关于该反应的说法错误的是( )
+2FeS+SO2(已配平),则下列关于该反应的说法错误的是( )
A.方框中的物质应为Cu2S
B.该反应的部分产物可用于硫酸工业
C.反应中SO2既是氧化产物又是还原产物
D.反应中若有1 mol SO2生成,则一定有4 mol电子发生转移
查看答案和解析>>
科目:高中化学 来源: 题型:
向100 mL FeI2溶液中逐渐通入Cl2,会依次生成I2、Fe3+、IO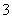 ,其中Fe3+、I2的物质的量随通入Cl2的物质的量n(Cl2)的变化如图所示,下列说法不正确的是(双选)( )
,其中Fe3+、I2的物质的量随通入Cl2的物质的量n(Cl2)的变化如图所示,下列说法不正确的是(双选)( )
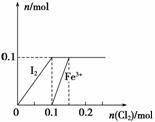
A.氧化性强弱:I2<Fe3+<IO
B.n(Cl2)=0.12 mol时,溶液中的离子主要有:Fe2+、Fe3+
C.若n(Cl2)∶n(FeI2)=6∶5,反应的离子方程式为2Fe2++10I-+6Cl2===5I2+2Fe3++12Cl-
D.若n(Cl2)∶n(FeI2)=2∶1,反应的离子方程式为2Fe2++4I-+3Cl2===2I2+2Fe3++6Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
能够充分说明在恒温恒容下的密闭容器中,反应2SO2(g)+O2(g) 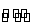
2SO3(g)已达平衡状态的标志是( )
A.容器中SO2、O2、SO3的物质的量之比为2∶1∶2
B.SO2和SO3的物质的量浓度相等
C.反应容器内压强不随时间变化而变化
D.单位时间内生成2 mol SO3的同时生成1 mol O2
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于酯类说法正确的是( )
A.乙酸乙酯和甲醛最简式相同
B.酯类都能发生水解反应
C.酯在酸性条件下水解程度比在碱性条件下大
D.只有有机酸和醇才能反应生成酯
查看答案和解析>>
科目:高中化学 来源: 题型:
向30 mL 1 mol·L-1的AlCl3溶液中逐渐加入浓度为4 mol·L-1的NaOH溶液,若产生0.78 g白色沉淀,则加入的NaOH溶液的体积可能为( )
A.3 mL B.7.5 mL C.15 mL D.17.5 mL
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com