


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
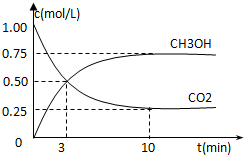 全球气候变暖已经成为全世界人类面临的重大问题,温家宝总理在“哥本哈根会议”上承诺到2020年中国减排温室气体40%.
全球气候变暖已经成为全世界人类面临的重大问题,温家宝总理在“哥本哈根会议”上承诺到2020年中国减排温室气体40%.| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| T/℃ | 165 | 175 | 185 | 195 |
| K | 111.9 | 74.1 | 50.6 | 34.8 |
| n(NH3) |
| n(CO2) |
| OH- |
| H+ |
| c(HCO3-):c(H2CO3) | 1.0 | 17.8 | 20.0 | 22.4 |
| pH | 6.10 | 7.35 | 7.40 | 7.45 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、配制FeC13溶液时,要滴加少量的盐酸 |
| B、加热蒸干并灼烧Na2SO3溶液,得到Na2SO4固体 |
| C、明矾净水 |
| D、氨态氮肥(含NH4+)不能与草木灰混合使用 |
查看答案和解析>>
科目:高中化学 来源: 题型:
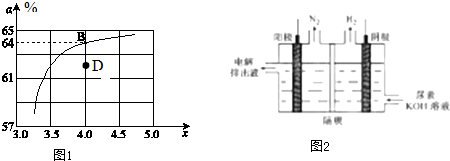
| A、2min末,A和B的浓度之比为5:3 |
| B、x=1 |
| C、2min末,B的浓度为1.5 mol?L-l |
| D、2min末,A的消耗浓度为0.5 mol?L-l |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在世界上我国首先合成了具有生命活力的蛋白质--结晶牛胰岛素 |
| B、蛋白质是组成细胞的基础物质,它是小分子物质 |
| C、蛋白质水解的最终产物是氨基酸 |
| D、高温灭菌的原理是加热后使蛋白质变性,从而使细菌死亡 |
查看答案和解析>>
科目:高中化学 来源: 题型:
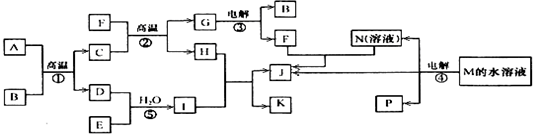
| B |
| H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
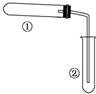 用如图装置(夹持、加热装置已略)进行实验,由②中现象,不能证实①中反应发生的是( )
用如图装置(夹持、加热装置已略)进行实验,由②中现象,不能证实①中反应发生的是( )| ①中实验 | ②中现象 | |
| A | 石蜡油在碎瓷片上受热分解 | Br2的CCl4溶液褪色 |
| B | 加热NH4Cl和Ca(OH)2混合物 | 酚酞溶液变红 |
| C | NaHCO3固体受热分解 | 澄清石灰水变浑浊 |
| D | 铁粉与水蒸气加热 | 肥皂水冒泡 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该溶液1 mL稀释至100 mL后,pH小于3 |
| B、向该溶液中加入等体积、pH为13的氢氧化钡溶液恰好完全中和 |
| C、该溶液中硝酸电离出的c(H+)与水电离出的c(H+)之比值为10-12 |
| D、该溶液中水电离出c(H+)是pH为3的硝酸中水电离出c(H+)的100倍 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com