
| A. | 将30 mL 0.5 mol/L NaOH溶液加水稀释到500 mL,所得溶液的NaOH的浓度为0.3 mol/L | |
| B. | 配制250 mL 1.0 mol/L H2SO4溶液,需要18 mol/L的浓H2SO4的体积约为13.9 mL | |
| C. | 0.270 kg质量分数为10%的CuCl2溶液中Cl-的物质的量为0.2 mol | |
| D. | 80 g NaOH溶于1 L水中所得的溶液的物质的量浓度为2 mol/L |
分析 A.稀释前后氢氧化钠的物质的量不变,根据稀释定律C1V1=C2V2计算判断;
B.根据稀释定律,稀释前后硫酸的物质的量不变,据此计算;
C.据m(溶质)=m(溶液)×ω(溶质)计算出溶液中CuCl2的质量,再计算出CuCl2的物质的量和Cl-的物质的量;
D.溶液的体积不等于水的体积.
解答 解:A.令稀释后NaOH的物质的量浓度为c,稀释前后氢氧化钠的物质的量不变,则:0.03L×0.5mol/L=c×0.5L,解得c=0.03mol/L,故A错误;
B.设需要浓硫酸的体积为x,根据稀释定律,稀释前后溶质的物质的量不变,则:250mL×1.0mol/L=x×18mol/L,解得x=13.9mL,故B正确;
C.0.270kg质量分数为10%的CuCl2溶液中m(CuCl2)=270g×10%=27g,所以n(CuCl2)=$\frac{27g}{135g/mol}$=0.2mol,则Cl-的物质的量为0.4mol,故C错误;
D.80 g NaOH溶于1 L水中,溶液的体积不等于水的体积,所以溶液的体积不知道,则不能计算物质的量浓度,故D错误.
故选B.
点评 本题考查了物质的量浓度的计算,题目等浓度,明确物质的量与摩尔质量、物质的量浓度之间的关系为解答关键,试题侧重基础知识的考查,培养了学生的化学计算能力.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
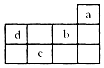
| A. | a原子最外电子层上的电子数为8 | |
| B. | b的最高价氧化物对应水化物为强酸 | |
| C. | c存在的两种常见氧化物分子组成上相差一个氧原子 | |
| D. | d和b都是第二周期的非金属元素,且d比b的非金属性强 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若三种溶液中c(H+)分别为a1 mol•L-1、a2 mol•L-1、a3 mol•L-1,则它们的大小关系为$\frac{1}{2}$a2=a1=a3 | |
| B. | 等体积的以上三种酸分别与过量的NaOH溶液反应,若生成的盐的物质的量依次为b1 mol、b2 mol、b3 mol,则它们的大小关系为b1=b2<b3 | |
| C. | 分别用以上三种酸中和一定量的NaOH溶液生成正盐,若需要酸的体积分别为V1、V2、V3,其大小关系为V1=V2=V3 | |
| D. | 分别与Zn反应,开始时生成H2的速率分别为v1、v2、v3,其大小关系为v2>v1>v3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com