
| A. | c(Na+)+c(H+)=c(X-)+c(OH-) | |
| B. | c(HX)+c(X-)=c(Na+) | |
| C. | 若混合液呈酸性,则c(X-)>c(Na+)>c(HX)>c(H+)>c(OH-) | |
| D. | 若混合液呈酸性,则c(Na+)>c(HX)>c(X-)>c(OH-)>c(H+) |
分析 A.根据溶液中的电荷守恒判断;
B.根据溶液中的物料守恒判断;
C.混合液呈酸性,说明HX的电离程度大于X-的水解程度,则c(H+)>c(OH-)、c(X-)>c(Na+)>c(HX);
D.根据C的分析可知c(X-)>c(Na+)>c(HX).
解答 解:A.根据电荷守恒可知:c(Na+)+c(H+)=c(X-)+c(OH-),故A正确;
B.根据物料守恒可得:c(HX)+c(X-)=2c(Na+),故B错误;
C.混合液为酸性,说明HX的电离程度大于X-的水解程度,则c(H+)>c(OH-)、c(X-)>c(Na+)>c(HX),溶液中离子浓度大小为:c(X-)>c(Na+)>c(HX)>c(H+)>c(OH-),故C正确;
D.根据C可知,溶液若呈酸性,则c(X-)>c(Na+)>c(HX)>c(H+)>c(OH-),故D错误;
故选BD.
点评 本题考查了离子浓度大小比较,题目难度中等,明确电荷守恒、物料守恒及盐的水解原理为解答关键,试题侧重考查学生的分析、理解能力及灵活应用能力.


 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案科目:高中化学 来源: 题型:多选题
| A. | 反应2Mg(s)+CO2(g)═C(s)+2MgO(s)能自发进行,则该反应的△H>0 | |
| B. | 电解法精炼铜时,粗铜作阳极,精铜作阴极 | |
| C. | 在硫酸钡悬浊液中加入足量饱和Na2CO3溶液处理,向所得沉淀中加入盐酸有气体产生,说明Ksp(BaSO4)>Ksp(BaCO3) | |
| D. | CH3COOH溶液加水稀释后,电离度增大,溶液中$\frac{C(C{H}_{3}CO{O}^{-})C({H}^{+})}{C(C{H}_{3}COOH)}$的值不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | H2、I2和 HI 分子中的化学键都是非极性共价键 | |
| B. | 断开 2 mol HI 分子中的化学键所需能量约为(c+b+a) kJ | |
| C. | 相同条件下,1 mol H2(g)和 1mol I2(g)总能量小于 2 mol HI (g)的总能量 | |
| D. | 向密闭容器中加入 2 mol H2(g)和 2 mol I2(g),充分反应后放出的热量为 2a kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
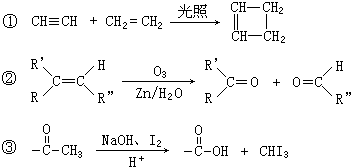
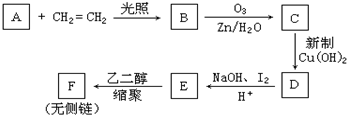
 ,CCH3COCH2CH2CHO,DCH3COCH2CH2COOH,F
,CCH3COCH2CH2CHO,DCH3COCH2CH2COOH,F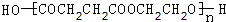 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a=b | B. | a=10-4b | C. | a=104b | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=8.3的NaHCO3溶液:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) | |
| B. | 0.1mol•L-1的Na2CO3溶液:c(OH-)=c(H+)+c(HCO3-)+c(CO32-) | |
| C. | 向0.2mol•L-1NaHCO3溶液中加入等体积0.1mol•L-1NaOH溶液:c(Na+)+c(H+)=c(HCO3-)+2c(CO32-) | |
| D. | 常温下,CH3COOH)和CH3COONa混合溶液【PH=7,c(Na+)=0.1mol•L-1】:c(CH3COO-)=0.1mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com