
【题目】对于可逆反应:2A(g)+B(g)2C(g)△H<0,下列各图中正确的是( )
A.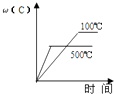
B.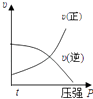
C.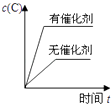
D.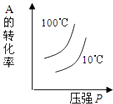
【答案】A
【解析】解:A、该反应为放热反应,温度升高平衡向逆反应方向移动,C的质量分数减小,故A正确;
B、根据反应前后的化学计量数的大小可以看出,增大压强平衡向正反应方向移动,正逆反应速率都增大,且V正>V逆 , 故B错误;
C、催化剂同等程度地改变正逆反应速率,平衡不发生移动,故C错误;
D、该反应为放热反应,温度升高平衡向逆反应方向移动,A的转化率降低,根据反应前后的化学计量数的大小可以看出,增大压强平衡向正反应方向移动,A的转化率增大,本题温度的曲线不正确,故D错误.
故选A.
【考点精析】本题主要考查了化学平衡状态本质及特征的相关知识点,需要掌握化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效)才能正确解答此题.


 快捷英语周周练系列答案
快捷英语周周练系列答案科目:高中化学 来源: 题型:
【题目】列式并计算下列各小题:
(1)某温度时,测得0.01 mol/L的NaOH溶液pH为11,求该温度下水的离子积常数Kw .
(2)在此温度下,将pH=a的NaOH溶液Va L与pH=b的硫酸Vb L混合.
①若所得混合溶液为中性,且a=12,b=2,则 Va:Vb=
②若所得混合溶液的pH=10,且a=12,b=2,则 Va:Vb= .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】往100 mL 1 mol·L -1 的AlCl3 溶液中滴加1 mol·L -1 的NaOH溶液,得3.9 g沉淀,则加入NaOH溶液的体积可能是
A. 100 mL B. 200 mL C. 300 mL D. 350 mL
【答案】D
【解析】氯化铝的物质的量是0.1mol,生成的氢氧化铝是3.9g÷78g/mol=0.05mol,如果氯化铝过量,则根据Al3++3OH-===Al(OH)3↓可知需要氢氧化钠是0.15mol,溶液体积是0.15mol÷1mol/L=0.15L=150mL;如果氢氧化钠过量,生成的氢氧化铝部分溶解,则0.1mol氯化铝需要0.3mol氢氧化钠生成0.1mol氢氧化铝,其中有0.05mol氢氧化铝溶解,根据Al(OH)3+OH-===AlO2-+2H2O可知又需要0.05mol氢氧化钠,则溶液体积是0.35mol÷1mol/L=0.35L=350mL,答案选D。
点睛:该题也可以借助图像解答,例如把强碱溶液逐滴加入到铝盐(Al3+)溶液中至过量的现象是:先有白色沉淀产生,然后沉淀逐渐溶解,有关反应:A→B:Al3++3OH-===Al(OH)3↓、B→D:Al(OH)3+OH-===AlO2-+2H2O,图像: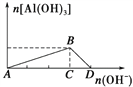 ,作纵坐标的垂线与图像有2个交点(B点除外),因此需要氢氧化钠的物质的量也有两种情况,解答时可以灵活应用。
,作纵坐标的垂线与图像有2个交点(B点除外),因此需要氢氧化钠的物质的量也有两种情况,解答时可以灵活应用。
【题型】单选题
【结束】
11
【题目】某溶液中有Fe3+、Mg2+ 、Fe2+ 和Al3+ 四种离子,若向其中加入过量的氢氧化钠溶液,微热并搅拌,再加入过量盐酸,溶液中大量增加的阳离子是
A. Fe3+ B. Mg2+ C. Fe2+ D. Al3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:I2+2S2O32﹣═S4O62﹣+2I﹣
相关物质的溶度积常数见下表:
物质 | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
Ksp | 2.2×10﹣20 | 2.6×10﹣39 | 1.7×10﹣7 | 1.3×10﹣12 |
(1)某酸性CuCl2溶液中含有少量的FeCl3 , 为得到纯净的CuCl22H2O晶体,加入 , 调至pH=4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)= . 过滤后,将所得滤液低温蒸发、浓缩结晶,可得到CuCl22H2O晶体.
(2)在空气中直接加热CuCl22H2O晶体得不到纯的无水CuCl2 , 原因是(用化学方程式表示).由CuCl22H2O晶体得到纯的无水CuCl2的合理方法是 .
(3)某学习小组用“间接碘量法”测定含有CuCl22H2O晶体的试样(不含能与I﹣发生反应的氧化性杂质)的纯度,过程如下:取0.36g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀.用0.100 0molL﹣1 Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00mL.
①可选用作滴定指示剂,滴定终点的现象是 .
②CuCl2溶液与KI反应的离子方程式为 .
③该试样中CuCl22H2O的质量百分数为
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室利用下列装置模拟工业生产制备少量硝酸. 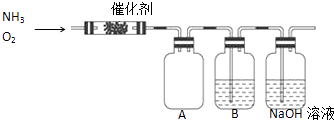
(1)B中试剂为 , NaOH溶液的作用是 .
(2)用过氧化钠与水反应制备氧气的化学方程式为 .
(3)实验时先用酒精喷灯预热催化剂,然后通入反应气体,当催化剂红热后撤离酒精喷灯,催化剂始终保持红热,温度可达到700℃以上.下列图示中,能够正确表示该反应过程能量变化的是 .
A.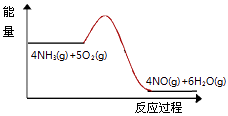
B.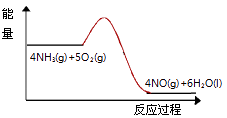
C.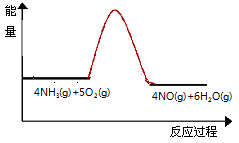
D.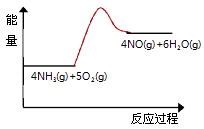
(4)已知2NO2(g)2NO(g)+O2(g)△H
NO2(g) ![]() N(g)+2O(g)
N(g)+2O(g)
NO(g) ![]() N(g)+O(g)
N(g)+O(g)
O2(g) ![]() 2O(g)
2O(g)
①计算反应的△H= .
②请解释高温下,氨气与氧气反应难以生成NO2的原因 .
(5)控制氨气和氧气的比例是制备硝酸的关键.
①当比例不合适时,A中不仅有红棕色气体产生,还伴有白烟.请用化学方程式表示白烟产生的原因 .
②欲使氨气尽可能完全转化为硝酸,理论上n(NH3):n(O2)的最佳比例为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列说法错误的是( )
A.20℃时,铝的密度为2.7 g/cm3 , 则1个Al原子的体积为( ![]() )cm3
)cm3
B.25℃、101KPa下,16 g O2与O3的混合气体中含电子数为8NA
C.25℃、101KPa下,11.2L Cl2含有的分子数小于0.5NA
D.0℃、101KPa下,等体积的CH4和CCl4中含C原子数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】10.0g某有机物在氧气中充分燃烧生成CO2和H2O,将这些燃烧产物与足量Na2O2充分反应,Na2O2能增重10.0g,此有机物不可能是( )
A. C6H12O6 B. C2H5OH C. HCHO D. CH3COOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不能用元素周期律解释的是( )
A.浓硫酸的氧化性强于稀硫酸
B.与冷水反应的速率:Na>Mg
C.向淀粉KI溶液中滴入氯水,溶液变蓝
D.原子半径:Al>Si>P
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两种气态烃组成的混合物0.1mol完全燃烧得0.16mol二氧化碳和3.6克水.下列说法正确的是( )
A.一定有甲烷
B.一定是甲烷和乙烯
C.可能有乙烷
D.一定有乙炔
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com