
| A. | 10g H2 和10g O2 | B. | 5.6L N2(标准状况下)和11gCO2 | ||
| C. | 9克H2O和11.2L O2 | D. | 224mL H2(标准状况下)和0.1mol N2 |
分析 根据N=nNA可知,物质的量相等时含有的分子数相同,分别根据n=$\frac{m}{M}$或n=$\frac{V}{{V}_{m}}$计算出各物质的物质的量,从而可知各种物质中所含分子数是否相同,注意标准状况下气体摩尔体积的使用条件,据此进行解答.
解答 解:A.10g氢气的物质的量为:$\frac{10g}{2g/mol}$=5mol,10g氧气的物质的量为:$\frac{10g}{18g/mol}$=$\frac{5}{9}$mol,二者物质的量不相等,则含有分子数不相同,故A错误;
B.标准状况下5.6L氮气的物质的量为:$\frac{5.6L}{22.4L/mol}$=0.25mol,11g二氧化碳的物质的量为:$\frac{11g}{44g/mol}$=0.25mol,二者的物质的量相同,则所含分子数相同,故B正确;
C.没有告诉在标准状况下,不能使用标准状况下的气体摩尔体积计算11.2L氧气的物质的量,故C错误;
D.标准状况下224mL氢气的物质的量为:$\frac{0.224L}{22.4L/mol}$=0.01mol,与0.1mol氮气的物质的量不相等,则含有分子数不同,故D错误;
故选B.
点评 本题考查了物质的量的计算,题目难度不大,明确物质的量与阿伏伽德罗常数、摩尔质量、气体摩尔体积之间的关系为解答关键,C为易错点,注意明确标准状况下气体摩尔体积的使用条件,试题培养了学生的化学计算能力.


 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | X>Y>Z>W | B. | Y>X>W>Z | C. | Z>X>Y>W | D. | Z>Y>X>W |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
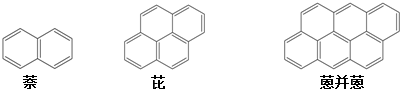
| A. | C50H30 | B. | C154H56 | C. | C154H60 | D. | C150H56 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 全部正确 | B. | 只有①⑤正确 | ||
| C. | 只有③正确 | D. | 以上说法都是错误的 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ⅥA族元素的原子半径越大,越容易得到电子 | |
| B. | I A族与VIIA族元素间能形成离子化合物也能形成共价化合物 | |
| C. | I A族元素的金属性比ⅡA族元素的金属性强 | |
| D. | 原子最外层电子数为2的元素一定位于元素周期表中的ⅡA族 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com