
【题目】研究表明,在CuZnO催化剂存在下,CO2和H2可发生两个平行反应,分别生成CH3OH和CO,反应的热化学方程式如下:
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)△H1 平衡常数K1 反应Ⅰ
CH3OH(g)+H2O(g)△H1 平衡常数K1 反应Ⅰ
CO2(g)+H2(g)![]() CO(g)+H2O(g)△H2 =+41.2kJmol-8平衡常数K2 反应Ⅱ
CO(g)+H2O(g)△H2 =+41.2kJmol-8平衡常数K2 反应Ⅱ
某实验室控制CO2和H2初始投料比为1:2.2,在相同压强下,经过相同反应时间测得如下实验数据:
T(K) | 催化剂 | CO2转化率(%) | 甲醇选择性(%) |
543 | Cat.1 | 12.3 | 42.3 |
543 | Cat.2 | 10.9 | 72.7 |
553 | Cat.1 | 15.3 | 39.1 |
553 | Cat.2 | 12.0 | 71.6 |
[备注]Cat.1:Cu/ZnO纳米棒;Cat.2:Cu/ZnO纳米片;甲醇选择性;转化的CO2中生成甲醇的百分比
(1)合成的甲醇可用于燃料电池的燃料,若电解质为稀烧碱溶液时甲醇燃料电池的正极反应式为________;研究证实,CO2也可在酸性水溶液中通过电解生成甲醇,则生成甲醇的反应发生在______极,该电极反应式是________________________________。
(2)从表中实验数据可以分析出,提高CO2转化成CH3OH的选择性的方法有______________。
(3)反应CO(g)+2H2(g)![]() CH3OH(g)的平衡常数K3=____________(用K1和K2表示)。
CH3OH(g)的平衡常数K3=____________(用K1和K2表示)。
(4)在恒压密闭容器中,由CO2和H2进行反应I合成甲醇,在其它条件不变的情况下,探究温度对化学平衡的影响,实验结果如图。

①△H1_________0(填“>”、“<”或“=”)
②有利于提高CO2平衡转化率的措施有___________(填标号)。
A.降低反应温度
B.投料比不变,增加反应物的浓度
C
D.混合气体中掺入一定量惰性气体(不参与反应)
(5)在T1温度时,将1.00molCO2和3.00molH2充入体积为1.00L的恒容密闭容器中,容器起始压强为P0,仅进行反应I。
①充分反应达到平衡后,若CO2转化率为a,则容器的压强与起始压强之比为________(用a表示)。
②若经过3h反应达到平衡,平衡后,混合气体物质的量为3.00mol,则该过程中H2的平均反应速率为____________(保留三位有效数字);该温度下反应的化学平衡常数K为____________(保留三位有效数字);平衡常数K可用反应体系中气体物质分压表示,即K表达式中用平衡分压代替平衡浓度,分压=总压×物质的量分数。写出上述反应压力平衡常数KP为____________(用P0表示,并化简)。
【答案】(1)O2+4e-+2H2O=4OH- 阴 CO2+6e-+6H+=CH3OH+H2O
(2)使用Cat2催化剂(或理想催化剂) 温度为543K(或降低温度) (3)K1/K2
(4)① < ② A (5)①![]() ②0.5mol·L-1·h-1 0.148(L·mol-1)2
②0.5mol·L-1·h-1 0.148(L·mol-1)2 ![]()
【解析】
试题分析:(1)电解质为稀烧碱溶液时,甲醇燃料电池的正极发生的是氧化反应,电极反应式为O2+4e-+2H2O=4OH-;利用CO2在酸性水溶液中通过电解生成甲醇,此时发生的反应为还原反应,则生成甲醇的反应发生在阴极,该电极反应式是CO2+6e-+6H+=CH3OH+H2O。
(2)从表中实验数据可以分析出,使用相同催化剂时温度降低CO2转化成CH3OH的选择性较好,另外在相同温度下,使用Cat.2催化剂CO2转化成CH3OH的选择性好,故提高CO2转化成CH3OH的选择性应选择使用Cat2催化剂(或理想催化剂或温度为543K(或降低温度);
(3)根据盖斯定律,反应CO(g)+2H2(g)![]() CH3OH(g)可以看成反应I-反应Ⅱ得到,则反应CO(g)+2H2(g)
CH3OH(g)可以看成反应I-反应Ⅱ得到,则反应CO(g)+2H2(g)![]() CH3OH(g)平衡常数K3=K1/K2;
CH3OH(g)平衡常数K3=K1/K2;
(4)①温度T2达到平衡时需要的时间短,可知反应速率快,对应的温度T2>T1,但此时水蒸气的含量降低,可知升高温度平衡逆向移动,故△H1<0;
②A.降低反应温度平衡正向移动,有得提高CO2的平衡转化率,正确;B.恒压条件下,投料比不变,增加反应物的浓度,不改变平衡的移动方向,无法提高CO2的转化率,错误;C.恒压条件下,增大CO2和H2的初始投料比,平衡正向移动,H2的转化率提高,但CO2的转化率降低,错误;D.混合气体中掺入一定量惰性气体,不改变平衡的移动方向,无法提高CO2的转化率,错误;答案为A。
(5)在T1温度时,将1.00molCO2和3.00molH2充入体积为1.00L的恒容密闭容器中,容器起始压强为P0,仅进行反应I。
①由化学平衡的三段模式法计算可知,
CO2 (g)+3H2(g)=CH3OH(g)+H2O(g)
起始 1 3 0 0
变化 a 3a a a
平衡 1-a 3-3a a a
根据相同条件下气体的压强之比等于物质的量之比,
则容器内的压强与起始压强之比为=(1-a+3-3a+a+a):(1+3)=(2-a):2,。
②若经过3h反应达到平衡,平衡后,混合气体物质的量为3.00mol,即(1-a+3-3a+a+a)=3.00mol,解得a=0.5mol,则该过程中H2的平均反应速率为![]() =0.500mol·L-1·h-1;该温度下反应的化学平衡常数K为
=0.500mol·L-1·h-1;该温度下反应的化学平衡常数K为![]() =0.148(L·mol-1)2;CO2的平衡分压为P0,H2的平衡分压为P0,CH3OH的平衡分压为P0,H2O的平衡分压为P0,上述反应压力平衡常数KP为
=0.148(L·mol-1)2;CO2的平衡分压为P0,H2的平衡分压为P0,CH3OH的平衡分压为P0,H2O的平衡分压为P0,上述反应压力平衡常数KP为![]() =
=![]() 。
。


科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述错误的是
A. 1.8g18O2分子与1.8g18O3分子中含有的中子数不同
B. 7.8gNa2S和7.8g Na2O2中含有的阴离子数目均为0.1NA
C. 23.4 g NaCl晶体中含有0.1NA个如图所示的结构单元
D. 含16 g氧原子的二氧化硅晶体中含有的δ键数目为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[选修5:有机化学基础]
制作软质隐形眼镜高分子材料(M)和聚酯PET的合成路线如下:
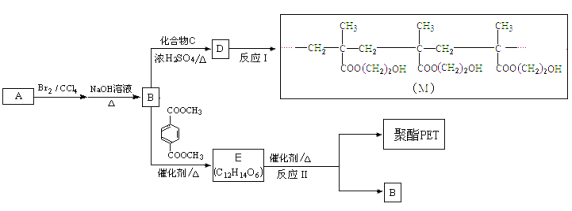
已知酯与醇可发生如下酯交换反应:
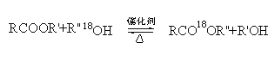 (R、R′、R″ 代表有机基团)
(R、R′、R″ 代表有机基团)
(1)A的相对分子质量是28,A、B分子中含有的官能团分别是 。
(2)B的名称是 。
(3)反应I的反应类型是_______(选填字母)。
a.加聚反应 b.缩聚反应
(4)有关B、C、D的说法正确的是 。
a.1mol B最多可以和1 mol C反应
b.C、D都能使Br2的CCl4溶液褪色
c.D与NaOH溶液共热后可以得到B和C
(5)B→D的化学方程式是 。
(6)C有多种同分异构体,其中一种是合成纤维维尼纶的单体,该分子在酸性环境下水解得到两种产物,它们的相对分子质量相差16,该同分异构体的结构简式是 。
(7)反应II的化学方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组用工业上废弃固体(主要成分Cu2S和Fe2O3)混合物制取粗铜和Fe2(SO4)3晶体,设计的操作流程如下:
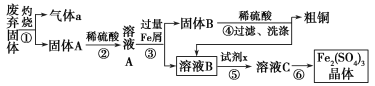
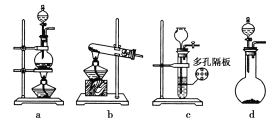
(1)③④操作中会有一种气体生成,若在实验室制备该气体,可选择下列哪些装置________。
(2)溶液B加稀硫酸酸化后加强氧化剂x,试剂x最好选择下列哪种试剂________(填序号)。
a.Cl2 b.H2O2 c.KMnO4
试剂x在酸性条件下与溶液B反应的离子方程式为_____________________________________。
(3)氧化铁是重要的工业颜料,用废铁屑制备它的流程如下:
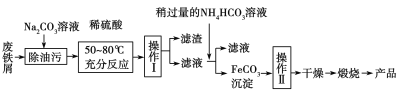
操作II的的名称是 ;
写出在空气中煅烧FeCO3的化学方程式_______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温、体积为2L的密闭容器中加入1molCO2和3molH2,发生如下的反应:
CO2(g)+3H2(g)![]() CH3OH(g) +H2O(g) △H<0。
CH3OH(g) +H2O(g) △H<0。
可认定该可逆反应在一定条件下已达到化学平衡状态的是( )
A.容器中CO2、H2、CH3OH、H2O的物质的量之比为1∶3∶1 ∶1
B.v正(CO2)=3v逆(H2)
C.容器内混合气体平均相对分子质量保持不变
D.容器中CO2、H2、CH3OH、H2O的物质的量浓度都相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过。下列有关叙述不正确的是
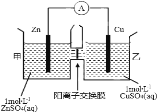
A.Zn电极上发生氧化反应
B.电子的流向为Zn→电流表→Cu
C.SO42-由乙池通过离子交换膜向甲池移动
D.电池工作一段时间后,乙池溶液的总质量明显增加
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水中蕴藏着丰富的资源。除从海水中可制得食盐外,还可以制取镁、钾、溴及其化工产品。从海水中制取金属镁的化工流程图如下:

已知:MgO的熔点为28000C,MgCl2的熔点为1180C。
回答下列问题:
(1)写出在卤水中加入石灰乳生成Mg(OH)2的离子方程式 。
(2)将海边大量存在的贝壳煅烧成石灰,并将石灰制成石灰乳。石灰制成石灰乳的过程
是 反应(填“吸热”或“放热”)
(3)操作A是指 。
(4)写出电解MgCl2制取Mg的化学方程式 。
(5)有同学认为:上述流程过于复杂,可直接加热Mg(OH)2得到MgO,再电解熔融的MgO制取金属镁,这样可简化实验步骤,体现实验的简约性原则。你同意该同学的想法吗?
(填“同意”或“不同意”),请说出你同意或不同意的理由 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 反应A(g)+3B(g)![]() 2C(g)+2D(g),在四种不同情况下用不同物质表示的反应速率
2C(g)+2D(g),在四种不同情况下用不同物质表示的反应速率
分别如下,其中反应速率最大的是( )
A.v(C)=0.04 mol/(L·s)
B.v(B)=0.06 mol/(L·min)
C.v(A)=0.15 mol/(L·min)
D.v(D)=0.01 mol/(L·s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 在不同浓度(c)、温度(T)条件下,蔗糖水解的瞬时速率(v)如下表。下列判断不正确的是( )

A.a=6.00
B.同时改变反应温度和蔗糖的浓度,v可能不变
C.b>318.2
D.温度为b时,蔗糖浓度减少一半所需的时间比318.2K时长
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com