
分析 (1)根据N=nNA计算出含有氧原子数目;C6H12O6的物质的量n(C6H12O6)=$\frac{1}{12}$n(H);
(2)根据n=$\frac{m}{M}$计算出22g二氧化碳的物质的量,根据V=nVm计算出标准状况下该二氧化碳的体积;
(3)根据n=$\frac{m}{M}$计算出氢氧化钠的物质的量,然后根据c=$\frac{n}{V}$计算出所得溶液的浓度;
(4)根据稀释过程中溶质的物质的量不变计算出稀释后溶液浓度;
(5)实验室中将饱和氯化铁溶液加入沸水中制取氢氧化铁胶体,据此书写化学方程式.
解答 解:(1)1.5molHNO3约含有4.5molO原子,N(O)=4.5NA,含0.6molH的C6H12O6的物质的量是:n(C6H12O6)=$\frac{1}{12}$n(H)=$\frac{0.6mol}{12}$=0.05mol,
故答案为:4.5NA;0.05;
(2)n(CO2)=$\frac{22g}{44g/mol}$=0.5mol,该气体在标准状况下的体积为:0.5mol×22.4L/mol=11.2L,
故答案为:0.5;11.2;
(3)4g氢氧化钠的物质的量为:$\frac{4g}{40g/mol}$=0.1mol,将其溶于水配成500mL溶液,此溶液中NaOH的物质的量浓度为:$\frac{0.1mol}{0.5L}$=0.2mol/L,
故答案为:0.2mol/L;
(4)将5mol/L盐酸10mL稀释到200mL,稀释过程中HCl的物质的量不变,则稀释后溶液的物质的量浓度是:$\frac{5mol/L×0.01L}{0.2L}$=0.25mol/L,
故答案为:0.25mol/L;
(5)制备胶体的原理是利用铁离子水解生成氢氧化铁胶体,反应的化学方程式为:FeCl3+3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3(胶体)+3HCl,
故答案为:FeCl3+3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3(胶体)+3HCl.
点评 本题考查了物质的量的计算、化学方程式书写,题目难度中等,明确物质的量与摩尔质量、气体摩尔体积、物质的量浓度之间的关系为解答关键,注意掌握氢氧化铁胶体的制备方法,试题培养了学生的灵活应用能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 15.5 g•mol-1 | B. | 85 g•mol-1 | C. | 55 | D. | 55 g•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
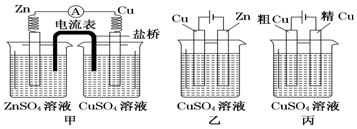
| A. | 甲是原电池,乙是电镀装置 | |
| B. | 甲、乙装置中,锌极上均发生氧化反应 | |
| C. | 乙装置中,铜极因发生氧化反应而溶解 | |
| D. | 乙装置中,c(Cu2+)不变,丙装置中,c(Cu2+)减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
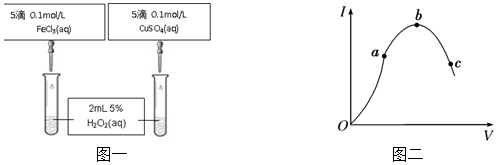
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠的摩尔质量等于它的相对原子质量 | |
| B. | CH4的摩尔质量为16 g/mol | |
| C. | 22.4 L任何气体的物质的量均为1 mol | |
| D. | 1 mol 任何物质均含有NA个分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
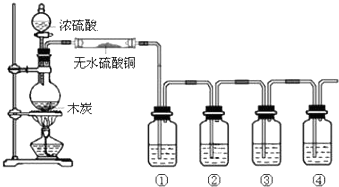
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
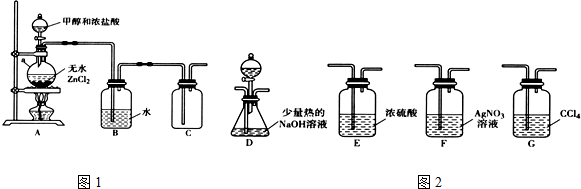
| 化学键 | C-Cl | C-Br |
| 键能(kJ•mol-1) | 330 | 276 |
| 化合物 | AgCl | AgBr |
| Ksp近似值 | 1.8×10-10 | 5×10-13 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com