
| A. | 金属元素在金属活动顺序表中的位置 | |
| B. | 1mol金属单质在反应中失去电子数目的多少 | |
| C. | 金属元素的最高价氧化物对应的水化物的碱性强弱 | |
| D. | 金属单质与水或酸反应置换出氢气的难易程度 |
分析 元素的金属性越强,在金属活动性顺序表中越在左边;金属的金属性越强,其最高价氧化物的水化物碱性越强、其单质的还原性越强、其单质与水或酸反应越剧烈,据此分析解答.
解答 解:A.元素的金属性越强,在金属活动性顺序表中越在左边,可以根据金属元素在金属活动顺序表中的位置判断金属性强弱,故A不选;
B.金属的金属性强弱与失电子难易程度有关,与失电子多少无关,故B选;
C.金属元素的最高价氧化物对应的水化物的碱性强弱,则该金属的金属性越强,故C不选;
D.金属单质与水或酸反应置换出氢气越容易,则该金属的金属性越强,所以可以根据金属单质与水或酸反应置换出氢气的难易程度判断金属性强弱,故D不选;
故选B.
点评 本题考查金属性强弱判断,为高频考点,金属的金属性强弱与失电子多少无关,与失电子难易程度有关,知道金属性强弱判断方法,易错选项是B.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
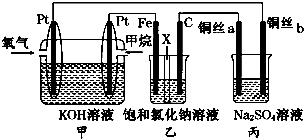
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
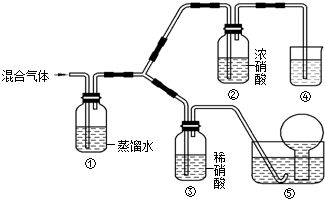
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com