
工业上制硫酸的设备分为三大部分,一是沸腾炉、二是接触室、三是吸收塔。在沸腾炉内煅烧黄铁矿生成二氧化硫;在接触室内有催化剂存在下二氧化硫进一步与氧气结合,生成三氧化硫;三氧化硫流经吸收塔时,采用98.3%的浓硫酸吸收,使三氧化硫最终与水化合形成硫酸。
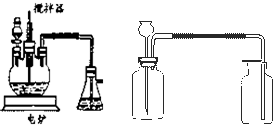
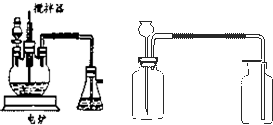
下面的装置是仿照工业上制备硫酸的工艺流程设计出来的,用于探究工业上为何采
用98.3%的浓硫酸吸收三氧化硫。

请回答下列问题:
(1)写出沸腾炉内煅烧黄铁矿的反应方程式:____________________________________;
(2)上图中的乙、丙分别相当于工业上制取硫酸装置中的:_______________、_______________;
(3)丙中的现象为_________________________、丁中的现象为_______________________。
(4)下图是压强对SO2平衡转化率的影响
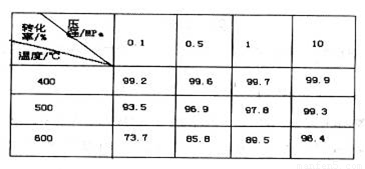
对SO2转化为SO3的反应,增大压强可使转化率________________,只所以通常采用常压操作是因为:____________________。
(1)4FeS2 +11O2 = 2Fe2O3 + 8SO2 (2分)
(2)接触室 吸收塔 (各1分)
(3)无酸雾 有酸雾 (各1分)
(4)增大 常压下SO2的转化率已经很大 (各1分)
【解析】
试题分析:(1)黄铁矿的主要成分为FeS2,被氧气氧化为Fe2O3和SO2。
(2)黄铁矿的煅烧在接触室内进行,SO3的吸收在吸收塔内进行。
(3)用浓H2SO4吸收SO3,无酸雾 ;用水吸收SO3会产生酸雾。
(4)增大压强使平衡向右移动,转化率增大;但是在常压下SO2的转化率已经很大,所以采用常压操作。
考点:本题考查化学方程式的书写、工业制取硫酸装置、反应现象、化学平衡。


 快乐5加2金卷系列答案
快乐5加2金卷系列答案科目:高中化学 来源: 题型:阅读理解
 在中学化学实验中,通常用无水硫酸铜检验少量水的存在.由于无水硫酸铜吸湿性很强,需要现制现用.
在中学化学实验中,通常用无水硫酸铜检验少量水的存在.由于无水硫酸铜吸湿性很强,需要现制现用.
| ||
| ||
| ||
| ||

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
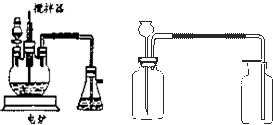 在中学化学实验中,通常用无水硫酸铜检验少量水的存在.由于无水硫酸铜吸湿性很强,需要现制现用.
在中学化学实验中,通常用无水硫酸铜检验少量水的存在.由于无水硫酸铜吸湿性很强,需要现制现用.查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com