
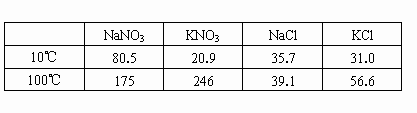
下表是四种盐在不同温度下的溶解度(g/100g水):
|
|
NaNO3 |
KNO3 |
NaCl |
KCl |
|
10℃ |
80.5 |
21.2 |
35.7 |
31.0 |
|
100℃ |
175 |
246 |
39.1 |
56.6 |
(假设:盐类共存时不影响各自的溶解度,分离晶体时,溶剂的损耗忽略不计)
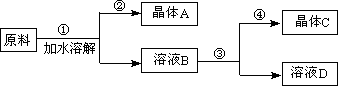
某同学设计用物质的量之比为1∶1的硝酸钠和氯化钾为原料,加入一定量的水制取硝酸钾的实验,其流程如下图所示:

(1)在①和②的实验过程中,需要控制的关键的实验条件是______________________,在上述晶体中,______(填“A”或“C”)应为硝酸钾晶体。
(2)在①的实验过程中,需要进行的操作依次是________________、________________、_____________。
(3)粗产品中可能含有杂质离子_______________________,检验其中一种离子的方法是________________________________________________________________________。
(4)为了洗涤所得的硝酸钾晶体,下列溶剂可用作洗涤剂的是___________(填编号)。
a.热水 b.冰水 c.95%的酒精 d.四氯化碳
(5)如取34.0g硝酸钠和29.8g氯化钾,加入70g水,在100℃蒸发掉50g水,维持该温度,过滤,析出晶体的质量为_______________。
(1)温度; C (1分)
(2)加水溶解、蒸发浓缩、趁热过滤
(3)Na+、Cl¯; 用洁净的铂丝或铁丝蘸取粗产品在火焰上灼烧,若火焰呈黄色,证明有Na+;或 取粗产品少许,加水配成溶液,加入硝酸酸化的硝酸银溶液,若有白色沉淀产生,证明有Cl¯。(2分)
(4)bc (2分)
(5)15.6g (2分)
【解析】
试题分析:(1)往水中加入等量的NaNO3 、KCl,溶液中有等量的Na+、NO3— 、K+、Cl—,任意两两组合可得到表中的4中盐类,根据表中数据,表中四种盐类在水中的溶解度随着温度的升高而升高,尤其是KNO3 随温度升高溶解度急剧增大,因此要从溶液中分离出KNO3 应该控制温度来实现分离,因为实验目的是得到硝酸钾晶体,因此晶体C才是目标产物。
(2)要得到硝酸钾晶体,应该利用NaCl随温度变化溶解度变化不大,而KNO3 随温度升高溶解度急剧增大的特点,在实验步骤1中先把固体溶解,然后蒸发浓缩,此时NaCl随温度变化溶解度变化不大以晶体形式析出,所以趁热过滤,分离后KNO3 留在了滤液B中,然后再对滤液B蒸发浓缩冷却结晶,KNO3 溶解度急剧减小析出晶体,再过滤可得KNO3 晶体。
(3)由于改变温度必然有少量杂质NaCl也会混在粗产品KNO3 晶体中,因此含有Na+、Cl¯杂质离子,检验的方法是用焰色反应检验钠离子,用硝酸银试剂检验氯离子。
(4)洗涤产品原则是能够起到洗涤杂质离子的作用同时尽量减少产品的损失,所以应尽可能用温度低的洗涤剂或者产品难溶但杂质可溶的洗涤剂,所以综合考虑应选bc。
(5)根据100℃蒸发后的溶液中NaCl为饱和溶液,KNO3为不饱和溶液,所以根据溶解度定义
100℃蒸发掉50.0克H2O后溶液中NaCl的质量为 ,又初始加入的物质为
,又初始加入的物质为 ,所以相当于n(NaCl)=0.4mol,即m总(NaCl)=0.4mol×58.5g/mol=23.4g,所以析出的NaCl有23.4g-7.82g=15.6g。
,所以相当于n(NaCl)=0.4mol,即m总(NaCl)=0.4mol×58.5g/mol=23.4g,所以析出的NaCl有23.4g-7.82g=15.6g。
考点:本题考查的是物质的分离方法重结晶以及溶解度的理解。


科目:高中化学 来源: 题型:
| NaNO3 | KNO3 | NaCl | KCl | |
| 10℃ | 80.5 | 20.9 | 35.7 | 31.0 |
| 100℃ | 175 | 246 | 39.1 | 56.6 |
查看答案和解析>>
科目:高中化学 来源:高中化学习题1 题型:022
下表是四种盐在不同温度下的溶解度(g/100g![]() ):
):

(假设:①盐类共存时不影响各自的溶解度;②分离晶体时,溶剂的损耗忽略不计)某同学设计用物质的量比为1∶1的硝酸钠和氯化钾为原料,加入一定量的水制取硝酸钾的实验,其流程如下图:
(1)在①和③的实验过程中,实验的关键条件是________;
(2)分离出晶体的②和④的操作是________(填“倾倒”、“蒸发”、“结晶”或“过渡”),硝酸钾是晶体________(填“A”或“C”);
(3)粗产品中可能含有的杂质离子是________,检验的方法是___________________________;
(4)欲将粗产品提纯,可采用的方法是________.
查看答案和解析>>
科目:高中化学 来源:桂壮红皮书·高中同步系列·活题巧解巧练·高一化学(上) 题型:038
表中是四种盐在不同温度下的溶解度(g).(计算时假定:①盐类共存时不影响各自的溶解度;②过滤晶体时,溶剂损耗忽略不计)
(1)取23.4g NaCl和40.4g KNO3,加70.0g H2O,加热溶解.在100℃时蒸发掉50.0g H2O,维持该温度过滤析出晶体,计算所得晶体的质量(m高温).将滤液冷却至10℃,待充分结晶后,过滤,计算所得晶体质量(m低温).
(2)另取34.0g NaNO3和29.8g KCl,同样进行如上实验.10℃时析出的晶体是________(写出化学式).100℃和10℃得到晶体质量( m和
m和 )分别是多少?
)分别是多少?
查看答案和解析>>
科目:高中化学 来源:物理教研室 题型:038
|
|
NaNO3 |
KNO3 |
NaCl |
KCl |
|
10℃ |
80.5 |
20.9 |
35.7 |
31.0 |
|
100℃ |
175 |
246 |
39.1 |
56.6 |
(计算时假定:①盐类共存时不会影响各自的溶解度;②过滤晶体时,溶剂损耗忽略不计)
(1)取23.4 g NaCl和40.4 g KNO3,加入70.0 g水,加热溶解.在100℃时,蒸发掉50.0 g水,维持该温度,过滤析出晶体,计算所得晶体的质量(m高温),将滤液冷却至10℃,待充分结晶后,过滤.计算所得晶体的质量(m低温).
(2)另取34.0 g NaNO3和29.8 g KCl
查看答案和解析>>湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com