
分析 (1)根据滴定的实验操作进行排序;
(2)准确量取10.00mL浓硫酸,需要用精密量具,精确到0.1,估读到0.01,所以学过的量具中,滴定管、移液管是能精确计量的仪器,注意溶液的碱性;未用标准液润洗碱式滴定管,标准液碱的浓度偏小;
(3)根据强酸强碱盐呈中性,应选择酸性或碱性范围内变色的指示剂,如甲基橙或酚酞;根据滴定过程中,目光应注视锥形瓶中溶液颜色的变化,以便准确判断终点的到达;
(4)根据c(待测)=$\frac{c(标准)c(待测)}{V待测}$分析不当操作对V(标准)的影响,以此判断浓度的误差.
解答 解:(1)用酸式滴定管准确量取浓硫酸样品10.00mL,在烧杯中用蒸馏水溶解,冷却至室温后,在250mL容量瓶中定容配成250mL稀硫酸,用移液管移取25.00mL稀硫酸于锥形瓶中并滴入几滴指示剂,将物质的量浓度为M mol/L的标准NaOH溶液装入碱式滴定管,调节液面,记下开始读数为V1,在锥形瓶下垫一张白纸,滴定至终点,记下读数V2,故正确的操作顺序为:G A C B D F E;故答案为:G A C B D F E;
(2)酸式滴定管可以精确到0.01mL,硫酸具有酸性,能用酸式滴定管来量取;未用标准液润洗碱式滴定管,标准液碱的浓度偏小,所以NaOH溶液润洗碱式滴定管的目的是保证标准液浓度不被稀释;
故答案为:酸式滴定管;保证标准液浓度不被稀释;
(3)硫酸和氢氧化钠反应生成硫酸钠,硫酸钠溶液呈中性,应选择酸性或碱性范围内变色的指示剂,如甲基橙或酚酞;在滴定过程中,目光应注视锥形瓶中溶液颜色的变化,故答案为:酚酞(或甲基橙);锥形瓶中溶液颜色的变化;
(4)实验时用稀硫酸润洗了锥形瓶,待测液的物质的量偏大,造成V(标准)偏高,根据c(待测)=$\frac{c(标准)c(待测)}{V待测}$分析,可知c(标准)偏高,故答案为:偏高.
点评 本题主要考查了滴定操作、指示剂的选择、误差分析等,难度不大,根据课本知识即可完成.


 天天练口算系列答案
天天练口算系列答案科目:高中化学 来源: 题型:选择题
| A. | 红棕色的NO2气体,加压后颜色先变深后变浅 | |
| B. | 高压比常压有利于合成SO3的反应 | |
| C. | 氯气在水中溶解度大于饱和食盐水中的溶解度 | |
| D. | 由H2、I2蒸气、HI气体组成的平衡体系加压后颜色变深 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
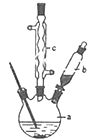 苯乙酸铜是合成优良催化剂、传感材料--纳米氧化铜的重要前驱体之一,下面是它的一种实验室合成路线:
苯乙酸铜是合成优良催化剂、传感材料--纳米氧化铜的重要前驱体之一,下面是它的一种实验室合成路线: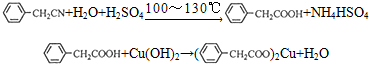
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
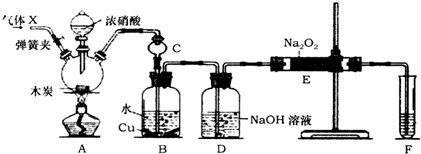
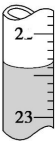 已知H2C2O4为二元中强酸.某化学兴趣小组为测定含Na2SO4、NaHC2O4和H2C2O4•2H2O的试样中各物质的质量分数,进行了如下实验:
已知H2C2O4为二元中强酸.某化学兴趣小组为测定含Na2SO4、NaHC2O4和H2C2O4•2H2O的试样中各物质的质量分数,进行了如下实验:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 滴定次数 | 1 | 2 | 3 | 4 |
| KMnO4溶液体积/mL | 20.80 | 20.01 | 20.00 | 19.99 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
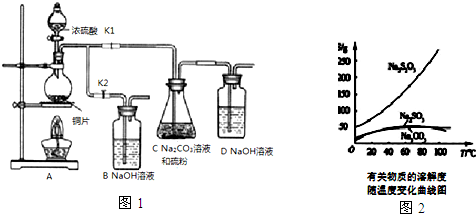
| 编号 | 1 | 2 | 3 | 4 |
| 溶液的体积/mL | 10.00 | 10.00 | 10.00 | 10.00 |
| 消耗I2标准溶液的体积/mL | 19.99 | 19.98 | 17.13 | 20.03 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间 | 开始 | 8小时 | 16小时 | 24小时 | 32小时 | 40小时 | 48小时 |
| pH | 5.0 | 4.8 | 4.5 | 4.3 | 4.2 | 4.0 | 4.0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com