
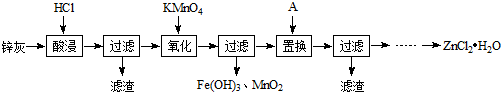
分析 铅锌烟灰(主要成分为ZnO,还含有少量Fe2+、Mn2+及微量其他重金属离子)加入盐酸酸浸,过滤后滤液中含有Zn2+、Fe2+、Mn2+等,加入高锰酸钾可生成Fe3+和MnO2,发生MnO4-+3Fe2++4H+=3Fe3++MnO2↓+2H2O,过滤后滤液中含有等Zn2+、Mn2+等,加入Zn置换出Mn,滤液中主要含有Zn2+,经蒸发浓缩、冷却结晶,过滤,冰水洗涤,低温烘干可得到ZnCl2•H2O,以此解答该题.
解答 解:铅锌烟灰(主要成分为ZnO,还含有少量Fe2+、Mn2+及微量其他重金属离子)加入盐酸酸浸,过滤后滤液中含有Zn2+、Fe2+、Mn2+等,加入高锰酸钾可生成Fe3+和MnO2,发生MnO4-+3Fe2++4H+=3Fe3++MnO2↓+2H2O,过滤后滤液中含有等Zn2+、Mn2+等,加入Zn置换出Mn,滤液中主要含有Zn2+,经蒸发浓缩、冷却结晶,过滤,冰水洗涤,低温烘干可得到ZnCl2•H2O,
(1)铅锌烟灰溶解在盐酸中,加热可促进溶解,但盐酸易挥发,应控制温度,故答案为:减少氯化氢的挥发;
(2)控制溶液的pH为5.写出KMnO4氧化Fe2+为Fe3+,同时生成MnO2,反应的方程式为MnO4-+3Fe2++4H+=3Fe3++MnO2↓+2H2O,由于溶液中含有氯离子,高锰酸钾可氧化氯离子而消耗,则实际生产中高锰酸钾用量远多于理论用量,
故答案为:MnO4-+3Fe2++4H+=3Fe3++MnO2↓+2H2O;部分高锰酸钾氧化氯离子而消耗;
(3)A用于置换Mn,为防止引入新杂质,应用锌,故答案为:Zn;
(4)滤液中主要含有Zn2+,经蒸发浓缩、冷却结晶,过滤,冰水洗涤,低温烘干可得到ZnCl2•H2O,如操作不当,则氯化锌水解生成Zn(OH)Cl,应控制蒸发时的温度不宜过高,或者向滤液中加入适量的盐酸,
故答案为:蒸发浓缩、冷却结晶,过滤,冰水洗涤,低温烘干;控制蒸发时的温度不宜过高,或者向滤液中加入适量的盐酸.
点评 本题考查物质的制备,为高考常见题型,侧重于学生的分析能力、实验能力和计算能力的考查,题目考查较为全面,能较好的培养学生良好的科学素养,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 甲烷的电子式: | |
| B. | 氮原子的L层电子轨道表示式: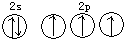 | |
| C. | 硫离子的核外电子排布式:1s22s22p63s23p4 | |
| D. | 碳-12原子:126C |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图所示是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡上的记录如下,则卡片上的描述合理的是( )
如图所示是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡上的记录如下,则卡片上的描述合理的是( )| A. | ①②③ | B. | ②④ | C. | ②③④ | D. | ③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 浓硫酸有强氧化性,铁在冷的浓硫酸中能发生钝化.某兴趣小组的同学发现将一定量的铁与浓硫酸加热时,观察到铁完全溶解,并产生大量气体.请你协助他们探究所得气体的成分.
浓硫酸有强氧化性,铁在冷的浓硫酸中能发生钝化.某兴趣小组的同学发现将一定量的铁与浓硫酸加热时,观察到铁完全溶解,并产生大量气体.请你协助他们探究所得气体的成分.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 吸收塔中的硫元素可能以单质形式存在 | |
| B. | 中和池中只发生生成沉淀的复分解反应 | |
| C. | 在中和池中加入盐酸酸化的BaCl2溶液,可能产生白色沉淀 | |
| D. | 由题意分析得到,沉淀可能是Cr(OH)6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 它们的原子核外电子层数随核电荷数的增加而增多 | |
| B. | 原子的最外层电子数都是7个 | |
| C. | 它们的单质的颜色随核电荷数的增加而加深 | |
| D. | 它们的氢化物的稳定性随核电荷数的增加而增强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com