
 ,
, ;
;

科目:高中化学 来源: 题型:
| A、K+、SO42-、OH-、AlO2- |
| B、K+、Ag+、Cl-、NO3- |
| C、Ba2+、Na+、OH-、CO32- |
| D、Na+、NH4+、NO3-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、焚烧 |
| B、粉碎后深埋 |
| C、倾倒在海洋中 |
| D、用化学方法加工成防水涂料或汽油 |
查看答案和解析>>
科目:高中化学 来源: 题型:
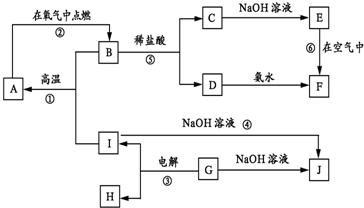
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图所示,在盛有水的烧杯中,铁圈和银圈的连接处吊着一根绝缘的细丝,使之平衡.小心地从烧杯中央滴入CuSO4溶液.
如图所示,在盛有水的烧杯中,铁圈和银圈的连接处吊着一根绝缘的细丝,使之平衡.小心地从烧杯中央滴入CuSO4溶液.查看答案和解析>>
科目:高中化学 来源: 题型:

| 气体 | O2 | Cl2 | NH3 |
| 分液漏斗中试剂 | 浓氨水 | ||
| 圆底烧瓶中试剂 | KMnO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 系统命名为
系统命名为 的炔烃的结构简式
的炔烃的结构简式查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com