
| Fe3+ | Co2+ | Co3+ | Al3+ | |
| pH(开始沉淀) | 1.9 | 7.15 | -0.23 | 3.4 |
| pH(完全沉淀) | 3.2 | 9.15 | 1.09 | 4.7 |
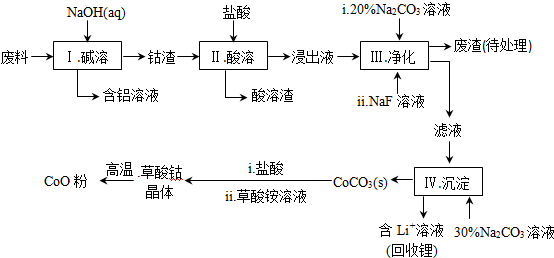
 LixC+Li1-xCoO2,LixC中Li的化合价为0价,该锂离子电池充电时阳极的电极反应式为LiCoO2-xe-=Li1-xCoO2+xLi+.
LixC+Li1-xCoO2,LixC中Li的化合价为0价,该锂离子电池充电时阳极的电极反应式为LiCoO2-xe-=Li1-xCoO2+xLi+. 分析 该工艺流程为:废料加入氢氧化钠溶液碱浸,得到钴渣,加入盐酸溶解后发生氧化还原反应,氧化钴氧化氯离子为氯气,过滤得到酸溶的溶液加入碳酸钠溶液和NaF溶液净化,除去锂离子和铁离子,在滤液中加入碳酸钠溶液沉淀钴离子为碳酸钴沉淀,加入盐酸和草酸铵溶液得到草酸钴晶体,高温分解得到氧化钴;
(1)步骤Ⅰ中铝与氢氧化钠反应生成偏铝酸钠和氢气;
(2)Co2O3与盐酸反应生成Cl2,依据得失电子守恒结合原子个数守恒写成反应的离子方程式;
(3)依据表中数据分析判断加入碳酸钠调节溶液PH,沉淀铁离子和锂离子,但不能沉淀钴离子;
(4)NaF与溶液中的Li+形成LiF沉淀,防止锂离子结合碳酸根离子形成碳酸锂沉淀;
(5)210~290℃的过程中只产生CO2和一种二元化合物,该二元化合物应该由钴元素和氧元素组成,该化合物中钴元素的质量分数为73.44%,则该氧化物中钴原子和氧原子的物质的量之比为$\frac{73.44%}{59}$:$\frac{1-73.44%}{16}$=3:4,即该氧化物的化学式为Co3O4,依据原子守恒配平书写反应的化学方程式;
(6)LiCoO2中锂元素化合价为+1价,则依据放电反应分析判断,LixC中锂元素化合价为0价,由锂离子电池的总反方程式可知C+LiCoO2→LixC+Li1-xCoO2为充电过程即为电解池,则锂硫电池给锂离子电池充电,LiCoO2为阳极失电子发生氧化反应,
解答 解:(1)步骤Ⅰ中铝与氢氧化钠反应生成偏铝酸钠和氢气,反应的离子方程式:2Al+2OH-+2H2O=2AlO2-+3H2↑;
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(2)Co2O3与盐酸反应生成Cl2,反应中钴元素化合价降低为+2价.氯元素化合价-1价变化为0价,依据得失电子守恒可知Co2O3的系数为1,Cl-的系数为2,结合原子个数守恒,反应的离子方程式:Co2O3+6H++2Cl-=2Co2++Cl2↑+3H2O;
故答案为:Co2O3+6H++2Cl-=2Co2++Cl2↑+3H2O;
(3)依据表中数据分析判断加入碳酸钠调节溶液PH,沉淀铁离子和锂离子,但不能沉淀钴离子,步骤Ⅲ中Na2CO3溶液的作用是调节溶液的pH,应使溶液的pH不超过7.15,废渣中的主要成分为LiF和Fe(OH)3;
故答案为:7.15; LiF、Fe(OH)3;
(4)NaF与溶液中的Li+形成LiF沉淀,此反应对步骤Ⅳ所起的作用是,降低溶液中Li+浓度,避免步骤Ⅳ中产生Li2CO3沉淀;
故答案为:降低溶液中Li+浓度,避免步骤Ⅳ中产生Li2CO3沉淀;
(5)210~290℃的过程中只产生CO2和一种二元化合物,该二元化合物应该由钴元素和氧元素组成,该化合物中钴元素的质量分数为73.44%,则该氧化物中钴原子和氧原子的物质的量之比为$\frac{73.44%}{59}$:$\frac{1-73.44%}{16}$=3:4,即该氧化物的化学式为Co3O4,所以该反应的方程式为:3CoC2O4+2O2$\frac{\underline{\;210-290℃\;}}{\;}$Co3O4+6CO2;
故答案为:3CoC2O4+2O2$\frac{\underline{\;210-290℃\;}}{\;}$Co3O4+6CO2;
(6)LiCoO2中锂元素化合价为+1价,则依据放电为原电池反应,锂元素化合价升高发生氧化反应分析判断,LixC中锂元素化合价为0价,是锂单质镶嵌在碳中做原电池负极,由锂离子电池的总反方程式可知C+LiCoO2→LixC+Li1-xCoO2为充电过程即为电解池,则锂硫电池给锂离子电池充电,LiCoO2为阳极失电子发生氧化反应:LiCoO2-xe-=Li1-xCoO2 +xLi+,C为阴极得电子发生还原反应:C+xe-+xLi+=LixC,
故答案为:0;LiCoO2-xe-=Li1-xCoO2+xLi+.
点评 本题通过从某工业废料中回收钴的工艺流程考查了化学方程式、离子方程式书写,确各个阶段固体成分及先后分解生成物成分是解本题关键,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. |  氧化剂 | B. |  爆炸品 | C. |  剧毒品 | D. |  遇湿易燃物品 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 实验室制取乙烯,常因温度过高而使乙醇和浓硫酸反应生成少量的二氧化硫.有人设计下列实验以确认上述混合气体中有乙烯和二氧化硫.试回答下列问题:
实验室制取乙烯,常因温度过高而使乙醇和浓硫酸反应生成少量的二氧化硫.有人设计下列实验以确认上述混合气体中有乙烯和二氧化硫.试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L 0.1mol/L的NaOH溶液中氧原子个数为0.1NA | |
| B. | 3g SiO2中Si-O数目为0.1NA | |
| C. | 0.1 mol钠与足量O2充分反应时,转移的电子数为0.1NA | |
| D. | 0.2 mol SO2与0.1mol O2充分反应,产物的分子数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯在银作催化剂的条件下与氧气反应生成环氧乙烷 | |
| B. | 乙烯水化法制乙醇 | |
| C. | 乙烯与氯化氢加成制氯乙烷 | |
| D. | 利用乙烯与氢气加成制得的乙烷与氯气在光照条件下制氯乙烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
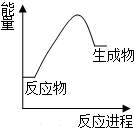
| A. | 生成物比反应物稳定 | |
| B. | 该反应的△H<0 | |
| C. | 该图可以表示石灰石高温分解反应 | |
| D. | 因为生成物的总能量高于反应物的总能量,所以该反应一定不能发生 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com