
科目:高中化学 来源:不详 题型:单选题

| A.途径①反应中体现了浓HNO3的强氧化性和酸性 |
| B.途径②的第二步反应在实际生产中可以通过增大O2浓度来降低成本 |
| C.由途径①和②分别制取1 mol H2SO4,理论上各消耗1 mol S,各转移6 mol e- |
| D.途径②与途径①相比更能体现“绿色化学”的理念是因为途径②比途径①污染相对小且原子利用率高 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.中性、漂白性 | B.酸性、漂白性 | C.只有酸性 | D.只有漂白性 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.证明SO2具有强氧化性和酸性 |
| B.若第1支试管改通H2S或Cl2溶解,后再通SO2气体,均不会产生沉淀 |
| C.若第2支试管改通NH3,后通SO2,不会产生沉淀 |
D.升高pH使SO2水溶液中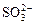 浓度增大 浓度增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com