
①P4 ②NH3 ③CCl4 ④金刚石 ⑤CH4 ⑥SiO2 ⑦H2S ⑧CO2?
A.①③④⑤? B.①③④⑤⑥? C.①③⑤? D.④⑤
 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案科目:高中化学 来源: 题型:阅读理解
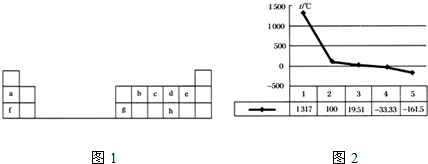
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源:学习高手选修化学(物质结构与性质人教版) 人教版 题型:013
|
下列分子构型呈正四面体形的是 ①P4 ②NH3 ③CCl4 ④金刚石 ⑤CH4 ⑥SiO2 ⑦H2S ⑧CO2 | |
| [ ] | |
A. |
①③④⑤ |
B. |
①③④⑤⑥ |
C. |
①③⑤ |
D. |
④⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com