
| A. | 0.15 mol/L的盐酸 | B. | 0.10mol/L的硫酸 | ||
| C. | 0.15 mol/L的醋酸 | D. | 0.10mol/L的氢硫酸 |
分析 首先判断电解质的强弱,如都为强电解质,则判断酸电离出氢离子的个数,以此解答该题.
解答 解:A.0.15 mol/L的盐酸中HCl是强电解质完全电离,溶液中氢离子浓度为0.15mol/L,
B.0.10mol/L的硫酸溶液中H2SO4为强电解质,溶液中氢离子浓度为0.20mol/L,
C.0.15 mol/L的醋酸溶液中醋酸为弱电解质,溶液中氢离子浓度小于0.15mol/L,
D.0.10mol/L的氢硫酸溶液中H2S为弱酸,溶液中氢离子浓度小于0.2mol/L,
上述分析可知溶液中H+ 浓度最大的是B,
故选B.
点评 本题考查电解质在溶液中的电离,题目难度不大,注意电解质的强弱判断和一元酸、二元酸的比较.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 原子半径 A>B>D>C | B. | 原子序数 D>C>B>A | ||
| C. | 离子半径 C>D>B>A | D. | 单质的还原性 A>B>D>C |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | υ(NH3)=0.04mol•L-1•min-1 | B. | υ(H2)=0.06mol•L-1•min-1 | ||
| C. | υ(N2)=0.06mol•L-1•min-1 | D. | υ(N2)=0.03mol•L-1•min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl是还原产物 | |
| B. | NaClO只含有离子键 | |
| C. | 当释放(标况下)2.24L Cl2时,一定有6.02×1022个氯分子扩散到室内 | |
| D. | 使用消毒液时滴加食醋可加快作用发挥,其原因用离子方程式表示为 ClO-+CH3COOH═HClO+CH3COO- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
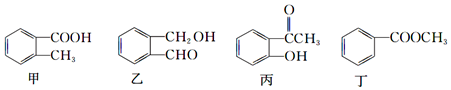
| A. | 甲:①②③④⑥⑦ | B. | 乙:①②③⑤⑥⑦ | C. | 丙:①②③④⑤⑥⑦ | D. | 丁:②③④⑤⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| ① | ② | ||||||
| ③ | ④ | ⑤ | ⑥ | ⑦ | |||
| ⑧ | ⑨ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 改用浓硫酸 | B. | 加热 | ||
| C. | 加入少量CuSO4固体 | D. | 将铁块改成铁粉 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com