
| A、阴离子的配位数:CsCl>NaCl>CaF2 |
| B、热分解温度:BaCO3>CaCO3>MgCO3 |
| C、熔点:NaF>MgF2>AlF3 |
| D、硬度:C3N4>金刚石>碳化硅 |
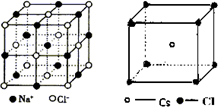
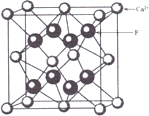 来分析;
来分析;
 ,结合图可知,CsCl为立方体心结构,Cl-的配位数是8;在CaF2晶胞中每个Ca2+连接4个氟离子,但在下面一个晶胞中又连接4个氟离子,所以其配位数为8,在CaF2晶胞中每个F-连接4个钙离子,所以其配位数为4;NaCl为立方面向结构,钠离子的配位数为6,Cl-的配位数是6,则阴离子的配位数:CsCl>NaCl>CaF2,故A正确;
,结合图可知,CsCl为立方体心结构,Cl-的配位数是8;在CaF2晶胞中每个Ca2+连接4个氟离子,但在下面一个晶胞中又连接4个氟离子,所以其配位数为8,在CaF2晶胞中每个F-连接4个钙离子,所以其配位数为4;NaCl为立方面向结构,钠离子的配位数为6,Cl-的配位数是6,则阴离子的配位数:CsCl>NaCl>CaF2,故A正确;

科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、O原子发生sp杂化 |
| B、O原子与H、Cl都形成σ键 |
| C、该分子为直线型分子 |
| D、该分子Cl原子显-1价 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| H2(g) | Br2(g) | HBr(g) | |
| 1mol分子中的化学键断裂时需要吸收的能量/kJ | 436 | a | 369 |
| A、404 | B、260 |
| C、230 | D、200 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、含2 mol H2SO4的浓硫酸与足量金属铜完全反应,产生SO2标准状况下的体积为22.4 L |
| B、78 g Na2O2中所含阴离子的数目是2NA |
| C、2.3g Na和足量的O2完全反应,在常温下燃烧时,转移电子数均为0.1NA |
| D、22.4 L CO和N2的混合气体中含有NA个气体分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溶液中Na+浓度增大,有O2放出 |
| B、溶液中的pH不变,水减少 |
| C、溶液中的Na+数目增加,有O2放出 |
| D、溶液中的pH增大,有O2放出 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com