
| A. | 1:4 | B. | 1:2 | C. | 1:1 | D. | 2:1 |
科目:高中化学 来源: 题型:解答题
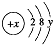
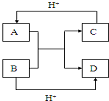
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验步骤 | 实验结论 |
| ①氯水+1mLCCl4,振荡,静置,观察四氯化碳层颜色 | 氧化性从强到弱的顺序:氯、溴、碘 |
| ②NaBr溶液+氯水+1mLCCl4,振荡,静置,观察四氯化碳层颜色 | |
| ③KI溶液+氯水+1mLCCl4,振荡,静置,观察四氯化碳层颜色 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
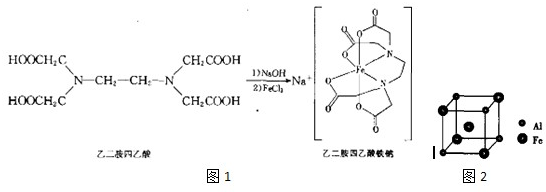
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 产生气体的质量为0.3g | |
| B. | 合金中镁与铝的物质的量之比为1:2 | |
| C. | 溶液X中剩余NaOH的物质的量为0.2 mol | |
| D. | 向溶液X中通入足量C02,过滤,将沉淀充分灼烧得固体15.6 g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入无水CuSO4再过滤 | B. | 加入生石灰再蒸馏 | ||
| C. | 加入浓硫酸再加热,蒸出乙醇 | D. | 将酒精直接加热蒸馏出乙醇 |
查看答案和解析>>
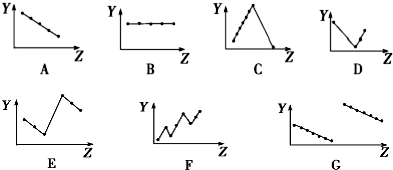
科目:高中化学 来源: 题型:推断题

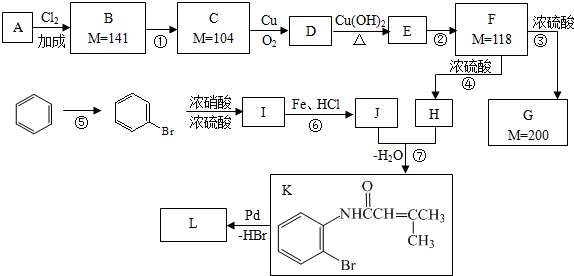
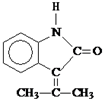
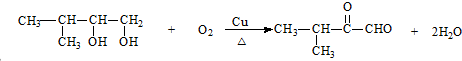 ;F→G:
;F→G: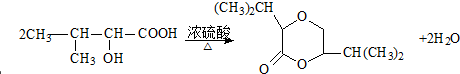 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化性:HClO>I2>SO42- | |
| B. | 淀粉KI溶液变蓝是因为I-被氧化为I2,淀粉遇I2变蓝 | |
| C. | 第二步蓝色消失的反应中1mol氧化剂失去电子的数目为2NA | |
| D. | 若将Na2SO3溶液加入氯水中,氯水褪色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com