
| A. | 2 | B. | 7 | C. | 10 | D. | 12 |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ③④ | C. | ①③ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
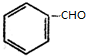 +H2(足量):
+H2(足量): +H2(足量)$\stackrel{催化剂}{→}$
+H2(足量)$\stackrel{催化剂}{→}$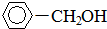 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 4种 | B. | 5种 | C. | 6种 | D. | 8种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向NaOH溶液中通入少量CO2:OH-+CO2═HCO3- | |
| B. | 用氨水吸收少量SO2:2NH3•H2O+SO2═2NH4++SO32-+H2O | |
| C. | Al(NO3)2溶液中加入过量氨水:Al3++4NH3•H2O═AlO2-+2H2O+4NH4+ | |
| D. | 向Fe2(SO4)3的酸性溶液中通入足量H2S:Fe3++H2S═Fe2++S↓+2H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在反应Cl2+2NaOH═NaCl+NaClO+H2O中,Cl2是氧化剂,NaOH是还原剂 | |
| B. | 在反应MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O中,HCl是氧化剂,MnO2是还原剂 | |
| C. | 在反应NaH+H2O═NaOH+H2↑中,H2既是氧化物又是还原产物 | |
| D. | 在反应H2S+H2SO4═S↓+SO2↑+2H2O中SO2是氧化产物,S是还原产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 +H2O2
+H2O2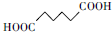 +H2O
+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com