
 若用AG来表示溶液的酸度,其表达式为:AG=lg[$\frac{c({H}^{+})}{c(O{H}^{-})}$].298K时,用0.1mol/L的盐酸溶液滴定10mL 0.1mol/L 的MOH溶液,滴定曲线如图所示:下列说法正确的是( )
若用AG来表示溶液的酸度,其表达式为:AG=lg[$\frac{c({H}^{+})}{c(O{H}^{-})}$].298K时,用0.1mol/L的盐酸溶液滴定10mL 0.1mol/L 的MOH溶液,滴定曲线如图所示:下列说法正确的是( )| A. | 该滴定实验最好选择酚酞作为指示剂 | |
| B. | C点时加入盐酸溶液的体积等于10 mL | |
| C. | 滴定过程中从A点到D点,溶液中水的电离程度先逐渐减小,后逐渐增大 | |
| D. | 若B点加入的盐酸溶液体积为5mL,则所得溶液中:c(M+)+2c(H+)═c(MOH)+2c(OH-) |
分析 A.用0.1mol/L的盐酸溶液滴定10mL 0.1mol/L MOH溶液,AG=-8,AG=lg[$\frac{{c({H^+})}}{{c(O{H^-})}}$],$\frac{c({H}^{+})}{c(O{H}^{-})}$=10-8,c(H+)c(OH-)=10-14,c(OH-)=10-3mol/L,说明MOH为弱碱,恰好反应溶液显酸性;
B.C点是AG=0,c(H+)=c(OH-)=10-7,溶液呈中性,溶质为MCl和MOH混合溶液;
C.A点到D点,碱的浓度逐渐减小,则水的电离程度增大,盐酸过量后,随着酸的浓度增大,可抑制水的电离;
D.若B点加入的盐酸溶液体积为5 mL,得到等浓度的MCl和MOH混合溶液,溶液中存在电荷守恒和物料守恒计算判断.
解答 解:A.用0.1mol/L的盐酸溶液滴定10mL 0.1mol/L MOH溶液,AG=-8,AG=lg[$\frac{{c({H^+})}}{{c(O{H^-})}}$],$\frac{c({H}^{+})}{c(O{H}^{-})}$=10-8,c(H+)c(OH-)=10-14,c(OH-)=10-3mol/L,说明MOH为弱碱,恰好反应溶液显酸性,选择甲基橙判断反应终点,故A错误;
B.C点是AG=0,c(H+)=c(OH-)=10-7,溶液呈中性,溶质为MCl和MOH混合溶液,C点时加入盐酸溶液的体积小于10 mL,故B错误;
C.A点到D点,碱的浓度逐渐减小,则水的电离程度增大,盐酸过量后,随着酸的浓度增大,可抑制水的电离,故C错误;
D.若B点加入的盐酸溶液体积为5 mL,得到等浓度的MCl和MOH混合溶液,溶液中存在电荷守恒c(M+)+c(H+)=c(OH-)+c(Cl-),物料守恒为:c(M+)+c(MOH)=c(Cl-),消去氯离子得到:c(M+)+2c(H+)=c(MOH)+2c(OH-),故D正确.
故选D.
点评 本题考查酸碱混合溶液定性判断及识图能力,为高频考点,侧重考查学生自学能力、理解能力及综合知识运用能力,关键是对AG定义的理解,离子浓度比较中等量关系判断常涉及电荷守恒、微粒守恒、质子恒等式运用,题目难度中等.


 每课必练系列答案
每课必练系列答案 巧学巧练系列答案
巧学巧练系列答案科目:高中化学 来源: 题型:多选题
| A. | 次氯酸的电子式: | B. | Cl-的结构示意图: | ||
| C. | O18的原子符号:${\;}_{8}^{18}$O | D. | CS2分子的结构式:S-C-S |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3He与3H中含有相同的中子数 | |
| B. | 通过化学反应可以实现3He与4He的相互转化 | |
| C. | 1 mol氦气含有质子数为2 mol | |
| D. | 3He与4He互为同素异形体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 1mol该物质最多可与3molNaOH反应 | |
| B. | 1mol该物质最多可与2molBr2反应 | |
| C. | 与NaHCO3、Na2CO3均能发生反应产生CO2 | |
| D. | 能使酸性KMnO4溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
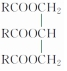 ”来表示,其中R为碳原子数目多于10的链烃基,可以相同也可以不同.分子式为C51H92O6的某油脂在稀硫酸中加热水解后得到A、B两种物质,若A的相对分子质量为92(已知:R1-CH═CH-R2$→_{H+}^{KMnO_{4}}$R1-COOH+R2-COOH),则
”来表示,其中R为碳原子数目多于10的链烃基,可以相同也可以不同.分子式为C51H92O6的某油脂在稀硫酸中加热水解后得到A、B两种物质,若A的相对分子质量为92(已知:R1-CH═CH-R2$→_{H+}^{KMnO_{4}}$R1-COOH+R2-COOH),则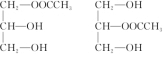 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4$\stackrel{高温}{→}$C+2H2 | |
| B. | CH3CH═CH2+Br2$\stackrel{CCI_{1}}{→}$CH3CHBrCH2Br | |
| C. | CH4+2O2$\stackrel{点燃}{→}$CO2+2H2O | |
| D. | Cl2+C2H6$\stackrel{光}{→}$C2H5Cl+HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 达到反应限度时,生成 SO3 为2 mol | |
| B. | 达到反应限度时,反应放出 197 kJ 的热量 | |
| C. | 达到反应限度时SO2、O2、SO3的分子数之比一定为2:1:2 | |
| D. | 达到反应限度时SO2的消耗速率必定等于SO3的消耗速率 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com