
分析 (1)根据m(溶质)=m(溶液)×ω计算溶质的质量,计算混合后溶液的质量,利用混合后溶质的质量等于原不同浓度溶液中氯化钠的质量之和计算混合后溶质氢氧化质量分数;
(2)根据c=$\frac{1000ρω}{M}$计算混合液的物质的量浓度;
(3)令需要氯化钠的物质的量为nmol,根据m=nM计算NaCl的质量,利用质量分数相等列方程计算;
(4)根据c=$\frac{n}{V}$可得,一定物质的量浓度溶液配制的误差都是由溶质的物质的量n和溶液的体积V引起的,误差分析时,关键要看配制过程中引起n和V怎样的变化:若n比理论值小,或V比理论值大时,都会使所配溶液浓度偏小;若n比理论值大,或V比理论值小时,都会使所配溶液浓度偏大.
解答 解:(1)将20.0g14%的NaCl溶液跟30.0g24%的NaCl溶液混合,混合后溶液的质量为20g+30g=50g,
令混合后NaCl的质量分数为ω,则:50g×ω=20g×14%+30g×24%,
解得ω=20%,
故答案为:20%;
(2)混合后溶液中NaCl的物质的量浓度为$\frac{1000×1.17×20%}{58.5}$mol/L=4.0mol/L,
故答案为:4.0;
(3)令需要氯化钠的物质的量为n mol,NaCl的质量为n mol×58.5g/mol=58.5g,则:$\frac{58.5n}{1000+58.5n}$=20%,解得n=4.3mol,
故答案为:4.3;
(4)A.所用NaOH已潮解,物质的量减小,所以减少,所以偏低,故错误;
B.定容时俯视观察液面,溶液的体积变小,浓度偏高,故正确;
C.未洗涤烧杯,无影响,故错误;
D.使物品和砝码放颠倒,若使用游码,称量的物质的质量偏小若不使用游码,称量质量不变,而配制500mL 0.5mol•L-1的NaOH溶液,称量氢氧化钠固体质量为:0.5×0.5×40=10g,不用游码,如果称量时砝码与NaOH的位置颠倒,无影响,故错误;
故选B.
点评 本题考查物质的量浓度、质量分数的有关计算,难度中等,注意对公式的理解与灵活运用,③中计算利用质量分数比利用物质的量浓度解答简单,注意体会.


科目:高中化学 来源: 题型:选择题
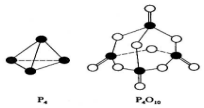 白磷与氧可发生如下反应:P4+5O2=P4O10.已知断裂下列化学键需要吸收的能量分别为:P-P akJ•mol-1、P-O bkJ•mol-1、P=O ckJ•mol-1、O=O dkJ•mol-1.根据图示的分子结构和有关数据估算生成1mol P4O10时,反应的能量变化正确的是( )
白磷与氧可发生如下反应:P4+5O2=P4O10.已知断裂下列化学键需要吸收的能量分别为:P-P akJ•mol-1、P-O bkJ•mol-1、P=O ckJ•mol-1、O=O dkJ•mol-1.根据图示的分子结构和有关数据估算生成1mol P4O10时,反应的能量变化正确的是( )| A. | 吸收(6a+5d-4c-12b)kJ热量 | B. | 放出(4c+12b-6a-5d)kJ热量 | ||
| C. | 吸收(4c+12b-4a-5d)kJ热量 | D. | 放出(4a+5d-4c-12b)kJ热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
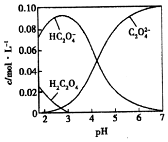 H2C2O4为二元弱酸.20℃时,配制一组c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.100mol•L-1的H2C2O4和NaOH混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如图所示.下列指定溶液中微粒的物质的量浓度关系一定正确的是( )
H2C2O4为二元弱酸.20℃时,配制一组c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.100mol•L-1的H2C2O4和NaOH混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如图所示.下列指定溶液中微粒的物质的量浓度关系一定正确的是( )| A. | pH=2.5的溶液中:c(H2C2O4)+c(C2O42-)>c(HC2O4-) | |
| B. | c(Na+)=0.100 mol•L-1的溶液中:c(H+)+c(H2C2O4)=c(OH-)+c(C2O42-) | |
| C. | c(HC2O4-)=c(C2O42-)的溶液中:c(Na+)>0.100 mol•L-1+c(HC2O4-) | |
| D. | pH=7.0的溶液中:c(Na+)=2(C2O42-) |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 苯甲醛 | 苯甲醇 | 苯甲酸 | 苯 | |
| 沸点/℃ | 178 | 205 | 249 | 80 |
| 熔点/℃ | 26 | -15 | 122 | 5.5 |
| 苯甲酸在水中的溶解度 | ||
| 17℃ | 25℃ | 100℃ |
| 0.21g | 0.34g | 5.9g |


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | x>0 a<0 | |
| B. | b<o c<o | |
| C. | x=3a-b-c | |
| D. | 1mol碳(s)在空气中不完全燃烧生成CO的焓变小与akJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
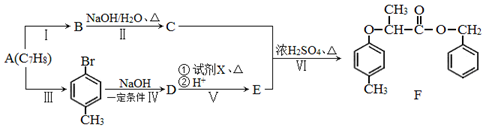
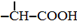 $→_{红磷、△}^{Cl_{2}}$
$→_{红磷、△}^{Cl_{2}}$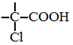
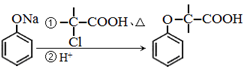
 +NaOH $→_{△}^{水}$
+NaOH $→_{△}^{水}$ +NaCl.
+NaCl. .
.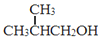 为原料制取
为原料制取 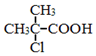 的合成路线图.
的合成路线图.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
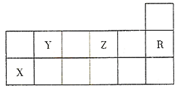
| A. | 热稳定性:Y的气态氢化物>Z的气态氢化物 | |
| B. | 简单离子半径比较Z小于X | |
| C. | X元素的单质能与所有强酸发生反应放出H2 | |
| D. | R的核外电子数与OH-的核外电子数相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com