
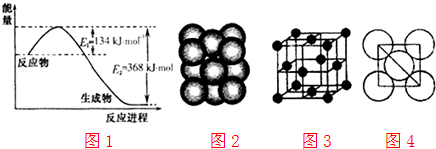
| 11.4g |
| 152g/mol |
 £¬
£¬ £»
£»| 1 |
| 2 |
| 1 |
| 8 |
| 1 |
| 2 |


 ŹĄ¼Ķ°ŁĶØÖ÷ĢåæĪĢĆŠ”ѧæĪŹ±Ķ¬²½“ļ±źĻµĮŠ“š°ø
ŹĄ¼Ķ°ŁĶØÖ÷ĢåæĪĢĆŠ”ѧæĪŹ±Ķ¬²½“ļ±źĻµĮŠ“š°ø ŹĄ¼Ķ°ŁĶØÓÅĮ·²āĻµĮŠ“š°ø
ŹĄ¼Ķ°ŁĶØÓÅĮ·²āĻµĮŠ“š°ø °Ł·Öѧɜ×÷Ņµ±¾ĢāĮ·ĶõĻµĮŠ“š°ø
°Ł·Öѧɜ×÷Ņµ±¾ĢāĮ·ĶõĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ

²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
| A”¢ŌŚ0.1 mol?L-1Na2CO3ČÜŅŗÖŠ£ŗc£ØOH-£©-c£ØH+£©=c£ØHCO3-£©+c£ØH2CO3£© |
| B”¢ŌŚ0.1 mol?L-1NaHCO3ČÜŅŗÖŠ£ŗc£ØNa+£©£¾c£ØHCO3-£©£¾c£ØCO32-£©£¾c£ØH2CO3£© |
| C”¢Ļņ0.2 mol?L-1NaHCO3ČÜŅŗÖŠ¼ÓČėµČĢå»ż0.1 mol?L-1NaOHČÜŅŗ£ŗc£ØCO32-£©£¾c£ØHCO3-£©£¾c£ØOH-£©£¾c£ØH+£© |
| D”¢³£ĪĀĻĀ£¬CH3COONaŗĶCH3COOH»ģŗĻČÜŅŗ[pH=7£¬c£ØNa+£©=0.1 mol?L-1]£ŗc£ØNa+£©=c£ØCH3COO-£©£¾c£ØCH3COOH£©£¾c£ØH+£©=c£ØOH-£© |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
A”¢Č©»ł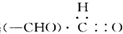 |
B”¢°±»ł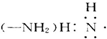 |
C”¢Ņ»ÖÖĢ¼ÕżĄė×Ó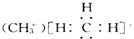 |
D”¢ŅŅŃõ»łĄė×Ó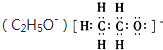 |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com